题目内容
在恒温恒容的密闭容器中,x mol A气体和y mol B气体,发生如下反应:2A(g)+3B(g)?2C(g)+D(g),平衡时混合气体总的物质的量为4mol,容器内的压强变为原来的0.8倍,A的转化率为50%.求平衡混合气体中C的体积分数.
考点:化学平衡的计算
专题:化学平衡专题
分析:恒温恒容的密闭容器中,x mol A气体和y mol B气体,
2A(g)+3B(g)?2C(g)+D(g)
起始量(mol) x y 0 0
变化量(mol) 0.5x 0.75x 0.5x 0.25x
平衡量(mol) x-0.5x y-0.75x 0.5x 0.25x
依据题干条件,平衡时混合气体总的物质的量为4mol,容器内的压强变为原来的0.8倍,气体压强之比等于气体物质的量之比,计算分析得到.
2A(g)+3B(g)?2C(g)+D(g)
起始量(mol) x y 0 0
变化量(mol) 0.5x 0.75x 0.5x 0.25x
平衡量(mol) x-0.5x y-0.75x 0.5x 0.25x
依据题干条件,平衡时混合气体总的物质的量为4mol,容器内的压强变为原来的0.8倍,气体压强之比等于气体物质的量之比,计算分析得到.
解答:
解:恒温恒容的密闭容器中,x mol A气体和y mol B气体,
2A(g)+3B(g)?2C(g)+D(g)
起始量(mol) x y 0 0
变化量(mol) 0.5x 0.75x 0.5x 0.25x
平衡量(mol) x-0.5x y-0.75x 0.5x 0.25x
平衡时混合气体总的物质的量为:4=x-0.5x+y-0.75x+0.5x+0.25x,
容器内的压强变为原来的0.8倍,气体物质的量为原来的0.8倍,4=(x+y)×0.8
x=2,y=3;
平衡混合气体中C的体积分数=
×100%=25%,
答:平衡混合气体中C的体积分数25%.
2A(g)+3B(g)?2C(g)+D(g)
起始量(mol) x y 0 0
变化量(mol) 0.5x 0.75x 0.5x 0.25x
平衡量(mol) x-0.5x y-0.75x 0.5x 0.25x
平衡时混合气体总的物质的量为:4=x-0.5x+y-0.75x+0.5x+0.25x,
容器内的压强变为原来的0.8倍,气体物质的量为原来的0.8倍,4=(x+y)×0.8
x=2,y=3;
平衡混合气体中C的体积分数=
| 0.5×2mol |
| 4mol |
答:平衡混合气体中C的体积分数25%.
点评:本题考查了化学平衡的计算应用,主要是三段式的计算应用,题目较简单.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
设NA代表阿伏伽德罗常数,下列说法正确的是( )
| A、22.4LNe含有NA个Ne分子 |
| B、1.7 g氨气所含有的电子数目为10NA |
| C、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移NA个电子 |
| D、常温常压下,16g O3含有的氧原子数为NA |
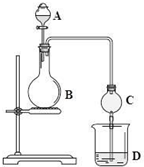 化学实验中,同一个装置可以用于不同的实验,例如图中的实验装置.(如图所示,B中可为固体或液体,可加热)
化学实验中,同一个装置可以用于不同的实验,例如图中的实验装置.(如图所示,B中可为固体或液体,可加热) (1)已知25℃时,C2H5OH(l)的燃烧热为1366.8kJ/mol,用热化学方程式表示:
(1)已知25℃时,C2H5OH(l)的燃烧热为1366.8kJ/mol,用热化学方程式表示: