题目内容
25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,求 a的取值范围.
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,则:Va?10-a=Vb?10b-14,结合Va<Vb和a=0.5b进行计算和判断.
解答:
解:两溶液混合后溶液恰好为中性,则:Va?c(H+)a=Vb?c(OH-)b,
=
=
=10(a+b-14)<1,
所以(a+b-14)<0,而a=0.5b,
即3a<14,a<
,
又pH=b=2a>7,a>
,
所以
<a<
,
答:a的取值范围为:
<a<
.
| Va |
| Vb |
| c(OH-)b |
| c(H+)a |
| ||
| c(H+)a |
所以(a+b-14)<0,而a=0.5b,
即3a<14,a<
| 14 |
| 3 |
又pH=b=2a>7,a>
| 7 |
| 2 |
所以
| 7 |
| 2 |
| 14 |
| 3 |
答:a的取值范围为:
| 7 |
| 2 |
| 14 |
| 3 |
点评:本题考查酸碱混合的定性判断和溶液PH的有关计算,题目难度较大,注意酸碱混合时酸碱物质的量的关系以及溶液PH与c(H+)、(OH-)的关系.

练习册系列答案
相关题目
下列实验过程和过程中涉及的离子反应方程式肯定正确的是( )
| A、除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2=2Fe3++2Cl- |
| B、在含有Mn2+的溶液中加入HNO3酸化,再加入PbO2,反应体系显紫红色,5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O |
| C、向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4+NH3?H2O+H2O |
| D、氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
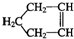 可简写为
可简写为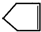 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: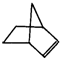
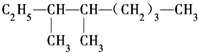 的系统命名法名称是
的系统命名法名称是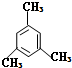 的名称是
的名称是