题目内容
 (1)已知25℃时,C2H5OH(l)的燃烧热为1366.8kJ/mol,用热化学方程式表示:
(1)已知25℃时,C2H5OH(l)的燃烧热为1366.8kJ/mol,用热化学方程式表示:(2)列出可逆反应Br2+H2O?H++Br-+HBrO的平衡常数的表达式:
(3)用惰性电极电解MgBr2溶液的阴极反应方程式:
(4)硫酸为电解质溶液的甲烷燃料电池中,正极反应方程式:
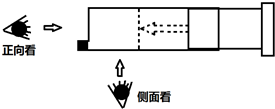
(5)已知右图针筒内发生可逆反应:2NO2?N2O4,平衡后,在恒温条件下把针筒往里推(减小体积),试描述观察到的现象.
①若从侧面观察,则看到的现象为:
②若从正向观察,则看到的现象为:
(6)可逆反应3A(g)3B(?)+C(?)△H>0,达到化学平衡后,升高温度.若B是气体,C不是气体,气体的平均相对分子质量
考点:热化学方程式,常见化学电源的种类及其工作原理,化学平衡常数的含义,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量计算分析,标注物质聚集状态和对应焓变写出热化学方程式;
(2)依据反应的离子方程式和平衡常数概念书写,注意纯液体不写入表达式;
(3)依据电解原理分析,用惰性电极电解MgBr2溶液阴极上是氢离子得到电子生成氢气;
(4)酸性溶液中甲烷燃料电池中甲烷失电子生成二氧化碳,氧气在正极得到电子生成水;
(5)2NO2?N2O4,反应是气体体积减小的反应,平衡后,在恒温条件下把针筒往里推(减小体积),增大压强平衡正向进行,二氧化氮是红棕色气体,四氧化二氮为无色气体;
(6)反应为吸热反应,升高温度平衡向正反应方向移动,结合物质的状态判断相对分子质量的变化;
(2)依据反应的离子方程式和平衡常数概念书写,注意纯液体不写入表达式;
(3)依据电解原理分析,用惰性电极电解MgBr2溶液阴极上是氢离子得到电子生成氢气;
(4)酸性溶液中甲烷燃料电池中甲烷失电子生成二氧化碳,氧气在正极得到电子生成水;
(5)2NO2?N2O4,反应是气体体积减小的反应,平衡后,在恒温条件下把针筒往里推(减小体积),增大压强平衡正向进行,二氧化氮是红棕色气体,四氧化二氮为无色气体;
(6)反应为吸热反应,升高温度平衡向正反应方向移动,结合物质的状态判断相对分子质量的变化;
解答:
解:(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,乙醇的燃烧热为-1366.8kJ/mol,燃烧热的热化学方程式为:
C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ?mol-1 ;
故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ?mol-1;
(2)列出可逆反应Br2+H2O?H++Br-+HBrO的平衡常数的表达式
;
故答案为:
;
(3)用惰性电极电解MgBr2溶液阴极上是氢离子得到电子生成氢气,阴极电极反应2H++2e-=H2↑;
故答案为:2H++2e-=H2↑;
(4)酸性溶液中甲烷燃料电池中,氧气在正极得到电子生成水,电极反应为O2+4e-+4H+=2H2O;
故答案为:O2+4e-+4H+=2H2O;
(5)二氧化氮是红棕色气体,四氧化二氮为无色气体,2NO2?N2O4,反应是气体体积减小的反应,平衡后,在恒温条件下把针筒往里推(减小体积),增大压强平衡正向进行,侧面观察,气体颜色先因为气体体积减小变深,随平衡移动颜色变浅,但比原平衡颜色深,正面观察应是颜色不变随后变浅;
故答案为:先变深后变浅,颜色不变随后变浅;
(6)反应为吸热反应,升高温度平衡向正反应方向移动,结合物质的状态判断相对分子质量的变化;
若B是气体,C不是气体,气体的物质的量不变,但气体的质量减小,则相对分子质量减小;
若B、C都不是气体,气体只有A,则气体的平均相对分子质量不变;
故答案为:变小;不变;
C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ?mol-1 ;
故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ?mol-1;
(2)列出可逆反应Br2+H2O?H++Br-+HBrO的平衡常数的表达式
| c(HBrO)c(Br-)c(H+) |
| c(Br2) |
故答案为:
| c(HBrO)c(Br-)c(H+) |
| c(Br2) |
(3)用惰性电极电解MgBr2溶液阴极上是氢离子得到电子生成氢气,阴极电极反应2H++2e-=H2↑;
故答案为:2H++2e-=H2↑;
(4)酸性溶液中甲烷燃料电池中,氧气在正极得到电子生成水,电极反应为O2+4e-+4H+=2H2O;
故答案为:O2+4e-+4H+=2H2O;
(5)二氧化氮是红棕色气体,四氧化二氮为无色气体,2NO2?N2O4,反应是气体体积减小的反应,平衡后,在恒温条件下把针筒往里推(减小体积),增大压强平衡正向进行,侧面观察,气体颜色先因为气体体积减小变深,随平衡移动颜色变浅,但比原平衡颜色深,正面观察应是颜色不变随后变浅;
故答案为:先变深后变浅,颜色不变随后变浅;
(6)反应为吸热反应,升高温度平衡向正反应方向移动,结合物质的状态判断相对分子质量的变化;
若B是气体,C不是气体,气体的物质的量不变,但气体的质量减小,则相对分子质量减小;
若B、C都不是气体,气体只有A,则气体的平均相对分子质量不变;
故答案为:变小;不变;
点评:本题考查化学平衡的移动,侧重于基础知识的考查,为高考高频考点,注意把握相关基础知识的积累,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列化合物中,只有在水溶液中才能导电的电解质是( )
| A、NaCl |
| B、CH3CH2OH |
| C、HCl |
| D、KOH |
短周期元素X和Y,X原子的电子层数为n,最外层电子数为(2n+1),Y原子最外层电子数是次外层电子数的3倍.下列说法一定正确的是( )
| A、X和Y都是非金属元素,其中X的最高化合价为+5价 |
| B、X与Y所能形成的化合物都是酸性氧化物 |
| C、元素X形成的盐化学式为KXO5 |
| D、X的氢化物极易溶于水,可以用来做喷泉实验 |