题目内容
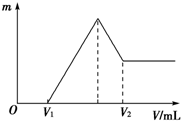
 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A、如图中a点对应的是AgBr的不饱和溶液 |
| B、在t℃时,Ksp(AgBr)=4.9×10-13 |
| C、在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K≈816 |
| D、在AgBr的饱和溶液中加入NaBr固体,可使溶液由b点到以c点 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A.在a点时Qc=c(Ag+)?c(Br-)<Ksp,判断AgBr为不饱和溶液;
B.根据图中c点的c(Ag+)和c(Br-)可得该温度下AgBr的Ksp为4.9×10-13;
C.根据K=
=
计算出平衡常数即可;
D.在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,溶解平衡逆向移动,c(Ag+)减小.
B.根据图中c点的c(Ag+)和c(Br-)可得该温度下AgBr的Ksp为4.9×10-13;
C.根据K=
| c(Cl-) |
| c(Br-) |
| Ksp(AgCl) |
| Ksp(AgBr) |
D.在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,溶解平衡逆向移动,c(Ag+)减小.
解答:
解:A.根据图象可知,在a点时Qc=c(Ag+)?c(Br-)<Ksp,所以a点为AgBr的不饱和溶液,故A正确;
B.结合图中c点的c(Ag+)和c(Br-)可知:该温度下AgBr的Ksp=7×10-7×7×10-7=4.9×10-13,故B正确;
C.反应AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数为:K=
=
=
≈816,故C正确;
D.在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,溶解平衡逆向移动,c(Ag+)减小,故D错误.
故选D.
B.结合图中c点的c(Ag+)和c(Br-)可知:该温度下AgBr的Ksp=7×10-7×7×10-7=4.9×10-13,故B正确;
C.反应AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数为:K=
| c(Cl-) |
| c(Br-) |
| Ksp(AgCl) |
| Ksp(AgBr) |
| 4×10-10 |
| 4.9×10-13 |
D.在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,溶解平衡逆向移动,c(Ag+)减小,故D错误.
故选D.
点评:本题考查了沉淀溶解平衡曲线,难度中等,曲线上的每个点都为AgBr饱和溶液,曲线以下为不饱和溶液;注意掌握Ksp的表达式及简单计算方法.

练习册系列答案
相关题目
下列依据相关实验得出的结论正确的是( )
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 |
| B、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定含有Na+ |
| C、将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 |
| D、向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
下列说法正确的是( )
| A、乙烯使溴水或酸性高锰酸钾褪色均属于加成反应 |
| B、用乙醇与浓硫酸加热至170℃制乙烯的反应属于取代反应 |
| C、用重铬酸钾溶液检验司机是否酒驾所发生的反应属于乙醇的氧化反应 |
| D、用“地沟油”生产生物柴油只发生酯化反应 |
下列有关溶液(常温下)中微粒浓度关系的叙述正确的是( )
| A、对于0.1 mol?L-1 Na2SO3溶液中:2c (Na+)═c(SO32-)+c(HSO3-)+c(H2SO3) |
| B、将CH3COOK溶液和盐酸溶液混合所得中性溶液:c(K+)>c(Cl-)=c(CH3COOH) |
| C、Ka(CH3COOH)=1.8×10-5,Ka(HCN)=4.9×10-10,物质的量浓度相同的CH3COONa、NaCN溶液中:c(CH3COO-)>c(CN-) |
| D、pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
下列各物质的名称中正确的是( )
| A、3,3-二甲基丁烷 |
| B、2,2-二甲基-3-乙基丁烷 |
| C、2,2,3-三甲基丁烷 |
| D、2,3-二甲基-4-乙基戊烷 |
在自然界中,既能以化合态存在又能以游离态存在的元素是( )
| A、碳 | B、硅 | C、氯 | D、铝 |
 将0.1mol的镁和铝的混合物溶于50mL 4mol?L-1 H2SO4溶液中,然后再滴加2mol?L-1的NaOH溶液.请回答下列问题:
将0.1mol的镁和铝的混合物溶于50mL 4mol?L-1 H2SO4溶液中,然后再滴加2mol?L-1的NaOH溶液.请回答下列问题: