题目内容
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )| A、气态氢化物稳定性:W>Y |
| B、Z与Q形成的化合物水溶液不一定显酸性 |
| C、Y的单质比W的单质沸点高 |
| D、原子半径从大到小排列是:Z>X>Y>W>Q |
考点:原子结构与元素的性质,原子结构与元素周期律的关系
专题:
分析:短周期主族元素.W的单质是黄色固体,则W为S,由X、Y、W在周期表中的相对位置可知,Y为O元素,X为C碳元素,X、Y、Z、W、Q是原子序数依次增大,所以Q为Cl,其中只有Z是金属,则Z可能为Na、Mg、Al中的一种,然后结合元素的单质化合物的性质及元素周期律来解答.
解答:
解:短周期主族元素.W的单质是黄色固体,则W为S,由X、Y、W在周期表中的相对位置可知,Y为O元素,X为C碳元素,X、Y、Z、W、Q是原子序数依次增大,所以Q为Cl,其中只有Z是金属,则Z可能为Na、Mg、Al中的一种,
A.非金属性Y>W,所以气态氢化物的稳定性Y>W,故A错误;
B.若Z为Na,则Z与Q形成的化合物NaCl的水溶液为中性,故B正确;
C.常温先,Y单质为气体,W的单质为固体,则Y单质沸点较高,故C错误;
D.同周期自左而右原子半径增大,电子层越多原子半径越大,故原子半径:Z>W>Q>X>Y,故D错误,
故选B.
A.非金属性Y>W,所以气态氢化物的稳定性Y>W,故A错误;
B.若Z为Na,则Z与Q形成的化合物NaCl的水溶液为中性,故B正确;
C.常温先,Y单质为气体,W的单质为固体,则Y单质沸点较高,故C错误;
D.同周期自左而右原子半径增大,电子层越多原子半径越大,故原子半径:Z>W>Q>X>Y,故D错误,
故选B.
点评:本题考查位置结构性质关系应用,注意把握元素周期表和元素周期律,元素的推断是解答本题的关键,W为淡黄色固体为突破口,注意Z元素的不确定性,难度不大.

练习册系列答案
相关题目
下列盐的溶液蒸干时,能得到原物质的是( )
| A、Na2SO3 |
| B、FeCl3 |
| C、KNO3 |
| D、NH4HCO3 |
在三个密闭容器中分别充入Ar、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
| A、p(H2)>p(O2)>p(Ar) |
| B、p(O2)>p(Ar )>p(H2) |
| C、p(Ar)>p(H2)>p(O2) |
| D、p(H2)>p(Ar)>p(O2) |
NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A、1 mol FeI2与足量氯气反应时转移的电子数为2NA |
| B、25℃时,56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
| C、常温下,1.20 g NaHSO4固体中含有的阴阳离子总数为0.3 NA |
| D、78 g Na2O2和Na2S的混合物中含有的阴离子数为NA |
下列依据热化学方程式得出的结论正确的是( )
| A、已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ?mol-,则氢气的标准燃烧热为-241.8 kJ?mol-11 |
| B、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C、已知2C(s)+2O2(g)=2CO2(g)△H=a2C(s)+O2(g)=2CO(g)△H=b,则a>b |
| D、已知P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定 |
下列化学用语描述中正确的是( )
A、含18个中子的氯原子的核素符号:
| ||
B、比例模型 可以表示CO2 分子或SiO2分子 可以表示CO2 分子或SiO2分子 | ||
| C、HCO3-的电离方程式为:HCO3-+H2O?CO32-+H3O+ | ||
| D、次氯酸的结构式:H-Cl-O |
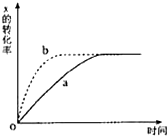 如图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进
如图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
| A、升高温度 |
| B、加大N的投入量 |
| C、缩小体积 |
| D、加大X的投入量 |
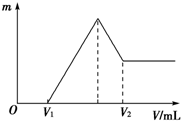 将0.1mol的镁和铝的混合物溶于50mL 4mol?L-1 H2SO4溶液中,然后再滴加2mol?L-1的NaOH溶液.请回答下列问题:
将0.1mol的镁和铝的混合物溶于50mL 4mol?L-1 H2SO4溶液中,然后再滴加2mol?L-1的NaOH溶液.请回答下列问题: