题目内容
13.下列各组离子在溶液中能大量共存的是( )| A. | Cu2+、Mg2+、SO42-、NO3- | B. | H+、Mg2+、SO42-、HCO3- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | NH4+、Ba2+、NO3-、OH- |
分析 如离子之间不发生反应生成沉淀、水或气体等,或不发生氧化还原反应、互促水解反应,则可大量共存,反之不能,以此解答.
解答 解:A.离子之间不反应,可大量共存,故A正确;
B.H+、HCO3-反应生成二氧化碳和水而不能大量共存,故B错误;
C.Ag+、Cl-反应生成AgCl沉淀而不能大量共存,故C错误;
D.NH4+、OH-反应生成一水合氨而不能大量共存,故D错误.
故选A.
点评 本题考查离子共存,为高频考点,侧重于复分解反应类型的判断,注意常见离子的性质以及反应类型的判断,难度不大,注意相关基础知识的积累.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
4.某消毒液的主要成分为NaClO,还含有一定量的NaOH,常温下分别取该消毒液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
| A. | 通入过量SO2:H+、Cl-、ClO-、HSO3- | |
| B. | 通入过量FeSO4溶液:Fe2+、H+SO42-、ClO- | |
| C. | 加入少量Al2(SO4)3溶液:Al3+、H+、ClO-、SO42- | |
| D. | 加入少量Na2O2固体:Na+、Cl-、ClO-、OH- |
1.下列关于Na2CO3和NaHCO3混合溶液的说法错误的是( )
| A. | 溶液中存在:[Na+]+[H+]=2[CO32-]+[HCO3-]+[OH-] | |
| B. | 若二者等物质的量混合,则溶液中[CO32-]=[HCO3-] | |
| C. | 该溶液中[H+]=Ka2[HCO3-]/[CO32-](Ka2为H2CO3的二级电离常数) | |
| D. | 该溶液加少量水稀释pH不发生明显变化 |
8.常温下,下列说法不正确的是( )
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 0.02mol/L的NaOH溶液与0.04mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)=c(HC2O4)+2c(H+) | |
| C. | 叠氨酸(NH3)与醋酸酸性相近,0.1mol•L-1 NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| D. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) |
18.晋•葛洪《抱朴子内篇•黄白》记载有“曾青涂铁,铁赤色如铜”(曾青即硫酸铜溶液),和“丹砂烧之成水银”(丹砂即硫化汞)等.下列说法不正确的是( )
| A. | “曾青涂铁”属于湿法炼铜 | |
| B. | “曾青涂铁”发生的是铁与硫酸铜的反应 | |
| C. | 汞不能用湿法冶炼 | |
| D. | “丹砂烧之成水银”属于热分解法 |
5.完成下列问题.
I.已知甲和乙为中学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色.试回答下列问题:
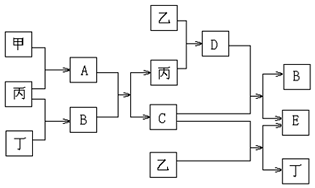
(1)A和 E的化学式分别为Na2O2、NaAlO2;
(2)A+B→C+丙的化学方程式:2Na2O2+2H2O=4NaOH+O2↑;
(3)D+C→B+E的离子方程式:2OH-+Al2O3=2AlO2-+H2O;
(4)1mol甲和1mol乙混合投入足量的B中,在标准状况下最多能产生44.8L丁气体.
II.在标准状况下,取甲、乙、丙各30.mL相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝混合物,得下表中有关数据(反应前后溶液体积不发生变化).
(1)甲组实验中,盐酸过量(填“过量”“适量”或“不足”);乙组实验中,盐酸不足(填“过量”“适量”或“不足”)
(2)盐酸的物质的量浓度为1mol/L..
(3)混合物中Mg和Al的物质的量之比为1:1.
I.已知甲和乙为中学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色.试回答下列问题:

(1)A和 E的化学式分别为Na2O2、NaAlO2;
(2)A+B→C+丙的化学方程式:2Na2O2+2H2O=4NaOH+O2↑;
(3)D+C→B+E的离子方程式:2OH-+Al2O3=2AlO2-+H2O;
(4)1mol甲和1mol乙混合投入足量的B中,在标准状况下最多能产生44.8L丁气体.
II.在标准状况下,取甲、乙、丙各30.mL相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝混合物,得下表中有关数据(反应前后溶液体积不发生变化).
| 实验序号 | 甲 | 乙 | 丙 |
| 混合物质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(2)盐酸的物质的量浓度为1mol/L..
(3)混合物中Mg和Al的物质的量之比为1:1.
18.25℃时,三种浓度均为0.1mol•L-1的溶液pH如下表,下列说法正确的是( )
| 序号 | ① | ② | ③ |
| 溶液 | NaClO | NaHCO3 | Na2CO3 |
| pH | 10.3 | 8.3 | 11.6 |
| A. | 酸性:HClO>H2CO3 | |
| B. | 由水电离产生的c(OH-):①>② | |
| C. | 溶液①中的c(ClO-)大于溶液②中的c(HCO3-) | |
| D. | 溶液③中:c(HCO3-)+c(CO32-)=0.1 mol•L-1 |
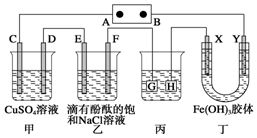 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.