题目内容
3.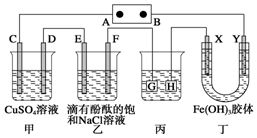 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:
(1)B极是电源的负 极;一段时间后,甲中溶液颜色变浅(填“变深”、“变浅”或“不变”);
(2)若甲、乙中C、D、E、F电极均只有一种单质生成,对应单质的物质的量之比为1:2:2:2.
(3)现用丙装置给铜件镀银,则H应该是镀件(填“镀层金属”或“镀件”),电镀液是AgNO3溶液.当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为5.4 g,甲中溶液的pH变小(填“变大”、“变小”或“不变”).
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的化学方程式是Fe+CuSO4$\frac{\underline{\;通电\;}}{\;}$Cu+FeSO4.
分析 将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极,A是电源的正极,B是负极;
(1)将直流电源接通后,F极附近呈红色,可知道氢离子在该电极放电,所以F即是阴极,B是负极,甲中硫酸铜中铜离子减少导致溶液颜色的变化;
(2)C、D、E、F电极转移的电子数目相等,根据转移电子数可计算生成的单质的量;
(3)电镀装置中,镀层金属必须做阳极,镀件做阴极,电镀液含有镀层金属阳离子;
根据乙中氢氧根离子的浓度计算其物质的量,结构电极反应式计算转移电子物质的量,各个电极上转移的电子数是相等的,据此计算丙中析出Ag的物质的量,进而计算质量;
电解硫酸铜的过程中水放电生成氧气,有硫酸生成,氢离子浓度增大,所以酸性增强,甲中溶液的pH变小;
(4)铁电极做阳极则该电极放电的是金属铁本身.
解答 解:将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极,A是电源的正极,B是负极;
(1)A是电源的正极,B电极是电源的负极,在A池中,电解硫酸铜的过程中,铜离子逐渐减少,导致溶液颜色变浅,故答案为:负极;变浅;
(2)C、D、E、F电极发生的电极反应分别为:4OH-═O2↑+2H2O+4e-、Cu2++2e-═Cu、2Cl-═Cl2↑+2e-、2H++2e-═H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2,
故答案为:1:2:2:2;
(3)电镀装置中,镀层金属必须做阳极,镀件做阴极,所以H应该是镀件,电镀液含有镀层金属阳离子,故电镀液为AgNO3溶液;
当乙中溶液的pH是13时即c(OH-)=0.1mol•L-1时(此时乙溶液体积为500mL),根据电极反应2H2O+2e-═H2↑+2OH-,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,
电解硫酸铜的过程中水放电生成氧气,有硫酸生成,所以氢离子浓度增大,所以酸性增强,甲中溶液的pH变小,
故答案为:镀件;AgNO3;5.4g;变小;
(4)C电极换为铁,则阳极铁失电子,阴极铜离子得电子,电解池总的化学反应式为:Fe+CuSO4$\frac{\underline{\;通电\;}}{\;}$Cu+FeSO4;
故答案为:Fe+CuSO4$\frac{\underline{\;通电\;}}{\;}$Cu+FeSO4.
点评 本题考查学生有关电解池的工作原理知识,综合性很强,难度较大,要求学生熟记教材知识,学以致用.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案| A. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2 $\frac{\underline{\;电解\;}}{\;}$Cu2++2Cl- | |
| B. | 铅蓄电池放电时,负极增重:Pb-2e-+SO42-=PbSO4 | |
| C. | 向碳酸钠溶液中滴加酚酞时,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 明矾可用于净水:Al3++3H2O?Al(OH)3↓+3H+ |
| 选项 | 实验 | 现象 | 结论 |
| A | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| B | 将铜粉加1.0mol•L-1Fe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| D | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 凡是能量达到活化能的分子发生的碰撞均为有效碰撞 | |
| B. | 熵增大的反应都是自发反应,熵减少的反应都不能进行 | |
| C. | 升高温度,可逆反应的正反应速率和逆反应速率都一定增大 | |
| D. | 使用催化剂可以增加反应物分子的能量,从而增大反应速率 |
| A. | ${\;}_{235}^{92}$U原子核中含有 92 个中子 | |
| B. | ${\;}_{235}^{92}$U原子核外有 143 个电子 | |
| C. | ${\;}_{235}^{92}$U 与 ${\;}_{92}^{238}$U 互为同位素 | |
| D. | ${\;}_{235}^{92}$U与${\;}_{92}^{238}$U 同一核素 |

| A. | ②①③④ | B. | ④③②① | C. | ④②①③ | D. | ③②④① |
| A. | 冰雪消融 | B. | 食物腐败 | C. | 钻木取火 | D. | 蜡炬成灰 |
| A. | Cu2+、Mg2+、SO42-、NO3- | B. | H+、Mg2+、SO42-、HCO3- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | NH4+、Ba2+、NO3-、OH- |