题目内容
下列对物质的结构组成表示恰当的是( )
| A、H2O2的结构式:H-O-H-O |
B、硫离子的结构示意图: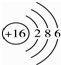 |
C、二氧化碳的比例模型: |
| D、氧化铁的化学式:FeO |
考点:结构式,原子结构示意图,球棍模型与比例模型
专题:化学用语专题
分析:A、双氧水分子中氧原子分别通过1对共用电子对与H原子、O原子结合;
B、硫原子获得2的电子形成硫离子,硫离子核外电子数为18,有3个电子层,各层电子数为2、8、8;
C、比例模型表示原子的比例大小、原子连接顺序、空间结构等,不能表示原子之间形成的化学键;
D、氧化铁中铁为+3价,O表现+2价,故正确化学式为:Fe2O3.
B、硫原子获得2的电子形成硫离子,硫离子核外电子数为18,有3个电子层,各层电子数为2、8、8;
C、比例模型表示原子的比例大小、原子连接顺序、空间结构等,不能表示原子之间形成的化学键;
D、氧化铁中铁为+3价,O表现+2价,故正确化学式为:Fe2O3.
解答:
解:A、双氧水分子中氧原子分别通过1对共用电子对与H原子和O原子结合,将所有共用电子对换成短线即为结构式,双氧水结构式为H-O-O-H,故A错误;
B、硫原子获得2的电子形成硫离子,硫离子核外电子数为18,有3个电子层,各层电子数为2、8、8,硫离子结构示意图为 ,故B错误;
,故B错误;
C、由选项中原子大小结合分子式CO2可知,大黑色球为氧原子、小黑色球为碳原子,实际碳原子半径大于氧原子半径,二氧化碳的比例模型为 ,故C正确;
,故C正确;
D、氧化铁中铁为+3价,O表现+2价,故正确化学式为:Fe2O3,故D错误,故选C.
B、硫原子获得2的电子形成硫离子,硫离子核外电子数为18,有3个电子层,各层电子数为2、8、8,硫离子结构示意图为
 ,故B错误;
,故B错误;C、由选项中原子大小结合分子式CO2可知,大黑色球为氧原子、小黑色球为碳原子,实际碳原子半径大于氧原子半径,二氧化碳的比例模型为
 ,故C正确;
,故C正确;D、氧化铁中铁为+3价,O表现+2价,故正确化学式为:Fe2O3,故D错误,故选C.
点评:本题考查了常见化学用语的书写判断,题目难度中等,注意掌握原子结构示意图、电子式、结构式、元素符号的概念及表示方法,注意比例模型与球棍模型的表示方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
 碳纳米管的内部嵌入活泼金属132Cs形成的“包合物”具有很小的密度,有极高的韧性和极强的导电性,有望将来成为优良的导电材料和光电材料.有关这种“包合物”性质的推测合理的是( )
碳纳米管的内部嵌入活泼金属132Cs形成的“包合物”具有很小的密度,有极高的韧性和极强的导电性,有望将来成为优良的导电材料和光电材料.有关这种“包合物”性质的推测合理的是( )| A、具有很强的还原性 |
| B、摩尔质量是144g/mol |
| C、属于原子晶体 |
| D、反应时每摩转移6.02×1023个电子 |
下列有关电化学的叙述正确的是( )
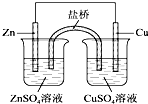

| A、为实现铁上镀铜,可把铁作为阳极 |
| B、氯碱工业通过电解熔融的NaCl生产Cl2 |
| C、如图所示,盐桥中的K+移向ZnSO4溶液 |
| D、氢氧燃料电池(碱性电解质溶液)中O2通入正极,电极反应为O2+2H2O+4e-═4OH- |
下列离子方程式书写正确的是( )
| A、将S02通入酸性KMnO4溶液:2MnO4-+5S02+2H20?2Mn2++5SO42-+4H+ |
| B、将Na2CO3溶液滴入等浓度等体积的盐酸中:C032-+H+?HCO3- |
| C、过氧化钠固体与水反应,2022-+2H20?40H-+02↑ |
| D、硫化钠水溶液呈碱性的原因:S2-+2H20?H2S+20H- |
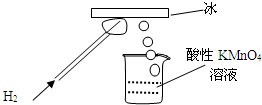 某研究性学习小组做了一个如图所示的实验,在导管口点燃氢气后,发现烧杯中酸性溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.下列判断正确的是
某研究性学习小组做了一个如图所示的实验,在导管口点燃氢气后,发现烧杯中酸性溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.下列判断正确的是( )
| A、该条件下H2燃烧放出的热量使冰分解产生了氧气 |
| B、该条件下H2被冷却为液态氢,液氢的水溶液具有氧化性 |
| C、该条件下生成的物质具有氧化性和还原性 |
| D、该条件下生成的水分子化学性质比较活泼 |
第三周期元素X、Y、Z可分别形成Xn+、Ym+、Zn-三种离子,已知m>n,且三种元素相应的最高价氧化物对应水化物两两之间会发生反应.下列说法中不正确的是( )
| A、Y为Al |
| B、Z的最高价氧化物对应水化物的分子式为HClO4 |
| C、X与Z结合形成离子化合物 |
| D、X、Y、Z原子半径Z>X>Y |