题目内容
17.下列反应中,水只作氧化剂的是( )| A. | C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2 | B. | Na2O+H2O═2NaOH | ||
| C. | CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O | D. | 2H2O $\frac{\underline{\;电解\;}}{\;}$ 2H2↑+O2 |
分析 水中H元素的化合价降低作氧化剂,水中O元素化合价升高,作还原剂,结合发生的化学反应中元素化合价的变化分析.
解答 解:A.C元素的化合价升高,水中H元素化合价降低,水作氧化剂,故A选;
B.反应中,没有元素化合价的变化,不是氧化还原反应,则水不是氧化剂,故B不选;
C.反应中水是生成物,水不是氧化剂,故C不选;
D.水中O元素的化合价升高,H元素化合价降低,水是还原剂和氧化剂,故D不选;
故选A.
点评 本题考查氧化还原反应,侧重氧化剂判断的考查,把握反应中元素的化合价变化为解答的关键,题目难度不大

练习册系列答案
相关题目
5.下列与“物质的量”相关的计算正确的是( )
| A. | 5.6 g CO和22.4 L CO2中含有的碳原子数一定相等 | |
| B. | n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$ | |
| C. | 标准状况下,11.2L M气体分子的质量为16 g,则M气体的摩尔质量是32 | |
| D. | 现有CO、CO2、O3三种气体,它们均含有1 mol O,则三种气体的物质的量之比为3:2:1 |
12.金属钠与下列物质的溶液反应,既有沉淀生成又有气体放出的是( )
| A. | Mg(NO3)2 | B. | HNO3 | C. | Na2SO4 | D. | NH4Cl |
2.下列离子方程式书写不正确的是( )
| A. | 溴乙酸与氢氧化钠溶液共热:BrCH2COOH+OH-$\stackrel{△}{→}$BrCH2COO-+H2O | |
| B. | 配置银氨溶液:Ag++2NH3•H2O═Ag(NH3)2++2H2O | |
| C. | 向新制Cu(OH)2中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 向苯酚钠溶液中通入少量CO2: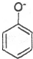 +CO2+H2O→ +CO2+H2O→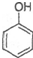 +HCO3- +HCO3- |
9.下列除去杂质的操作方法不正确的是( )
| A. | 镁粉中含少量铝粉:加足量氢氧化钠溶液充分搅拌后过滤 | |
| B. | 碳酸钠溶液中含少量碳酸氢钠:加足量澄清石灰水 | |
| C. | 自来水中含少量Fe3+:蒸馏 | |
| D. | 硝酸钾固体中含少量氯化钾:配制80℃的饱和溶液,冷却、结晶、过滤、洗涤干燥 |
6.有一铁粉和氧化铜的混合物8.32g,进行如下实验:

根据实验所得数据,有关说法正确的是( )

根据实验所得数据,有关说法正确的是( )
| A. | 无色气体的质量为0.2g | |
| B. | 原混合物中铁的质量为7.0g | |
| C. | 反应后的溶液中金属离子物质的量为0.1 mol | |
| D. | 反应消耗的H2SO4物质的量为0.15 mol |
7.在1.52g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成2.54g沉淀,则下列表示气体X组成的选项中合理的是( )
| A. | 0.03molNO、0.01molNO2 | B. | 0.03molNO2、0.01molNO | ||
| C. | 0.06molNO | D. | 0.03molNO2 |
 .
.