题目内容
2.下列说法正确的是( )| A. | 水溶液中能电离出H+的化合物叫做酸 | |
| B. | 实验测得2mol某气体体积为44.8L,则测定条件一定是标准状况 | |
| C. | 摩尔是七个基本物理量之一 | |
| D. | 化合物分为酸、碱、盐和氧化物是用树状分类法分类的 |
分析 A、电离出的阳离子全部是氢离子的化合物为酸;
B、气体摩尔体积的数值受温度和压强影响;
C、摩尔是物质的量的单位;
D、酸、碱、盐和氧化物均属于化合物.
解答 解:A、电离出的阳离子全部是氢离子的化合物为酸,但能电离出氢离子的化合物不一定为酸,如硫酸氢钠,故A错误;
B、气体摩尔体积的数值受温度和压强影响,在标况下气体摩尔体积为22.4L/mol,但气体摩尔体积为22.4L/mol时不一定为标况下,故B错误;
C、摩尔是物质的量的单位,物质的量是七个基本物理量之一,故C错误;
D、酸、碱、盐和氧化物均属于化合物,故化合物分为酸碱盐和氧化物属于树状分类法,故D正确.
故选D.
点评 本题考查了酸的概念以及物质的量和摩尔之间的关系等,难度不大,应注意的是标况下气体摩尔体积为22.4L/mol,但当气体摩尔体积为22.4L/mol时不一定为标况.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.在碳酸钙中加入适量盐酸至二者恰好完全反应,得到溶液M.下列离子在溶液M中能大量共存,且所得溶液为无色的是( )
| A. | Na+、K+、Cl-、NO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、Ag+、NO3-、HCO3- | D. | Na+、NH4+、CO32-、OH- |
17.下列有关化学用语表示正确的是( )
| A. | H3O+的电子式: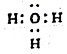 | |
| B. | 氨基的结构式:-NH2 | |
| C. | 乙烷的二氯代物有两种(不考虑立体异构) | |
| D. | NaHS显碱性的原因:HS-+H2O?S2-+H3O+ |
14.下列关于同温同压下的两种气体 12C18O和14N2的判断不正确的是( )
| A. | 体积相等时密度不相等 | B. | 原子数相等时具有的中子数不相等 | ||
| C. | 体积相等时具有的电子数相等 | D. | 质量相等时具有的质子数相等 |
11.有X、Y两种元素,原子序数小于等于20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数).下列说法正确的是( )
| A. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| B. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 | |
| C. | 若X元素形成的单质是X2,则Y元素形成的单质一定是Y2 | |
| D. | 若Y的最高正价为m,则X的最高正价一定为m |
12.已知25℃时,Ka(HF)=3×10-4,Ksp(CaF2)=1.46×10-10.现向1L0.2mol•L-1HF溶液中加入1L0.2mol•L-1CaCl2溶液,则下列说法中正确的是( )
| A. | 25℃时,0.1mol•L-1HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中没有沉淀产生 | |
| D. | 该体系中HF与CaCl2反应产生沉淀 |
 增大
增大