题目内容
下列有关溶液中微粒的物质的量浓度关系正确的是
A.某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A)
B.0.2 mol·L-1 CH3COONa溶液与0.1 mol·L-1盐酸等体积混合后的酸性溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+)
C.室温下,向100mL 0.5mol/L的Na2CO3溶液中加入0.05molCaO,溶液中 增大
增大
D.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3·H2O)+c(Fe2+)=0.3 mol·L-1
练习册系列答案
相关题目
某同学按下列步骤配制500 mL 0.20 mol·L-1KCl溶液,请回答有关问题。
实验步骤 | 有关问题 |
(1)计算所需KCl的质量 |
|
(2)称量KCl固体 | 称量过程中主要用到的仪器是__________ |
(3)将KCl加入100 mL烧杯中,加适量蒸馏水溶解 |
|
(4)将烧杯中的溶液转移至500 mL容量瓶中,洗涤2至3次并将洗涤液转入容量瓶中 | 为防止溶液溅出,应该采取的措施是______________________________ |
(5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是______________________________ |
4.下列各组原子中,彼此化学性质一定相似的是( )
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 | |
| C. | 2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
1.把4mol A气体和4mol B气体混合放入2L的恒容密闭容器中,在一定条件下发生反应:2A(g)+2B(g)?C(g)+2D(g);经5min达到平衡,测得压强减小了10%,下列说法中正确的是( )
| A. | 平衡体系中C的体积分数为$\frac{1}{9}$ | B. | 平衡时A的浓度为2.4mol/L | ||
| C. | D的平均速率为0.32mol/L•min | D. | B的转化率为20% |
2.下列说法正确的是( )
| A. | 水溶液中能电离出H+的化合物叫做酸 | |
| B. | 实验测得2mol某气体体积为44.8L,则测定条件一定是标准状况 | |
| C. | 摩尔是七个基本物理量之一 | |
| D. | 化合物分为酸、碱、盐和氧化物是用树状分类法分类的 |


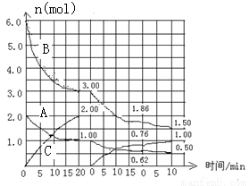
 cC(g) △H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
cC(g) △H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示: