题目内容
将氯化铵固体与14.8g足量熟石灰混合加热,使之充分反应.试计算:
(1)写出氯化铵与熟石灰反应的方程式.
(2)生成的氨气在标准状况下的体积是多少升?
(3)若将这些氨气配成200mL氨水,该氨水的物质的量浓度是多少?
(1)写出氯化铵与熟石灰反应的方程式.
(2)生成的氨气在标准状况下的体积是多少升?
(3)若将这些氨气配成200mL氨水,该氨水的物质的量浓度是多少?
考点:化学方程式的有关计算
专题:计算题
分析:(1)氯化铵固体和熟石灰混合加热生成氨气、水和氯化钙;
(2)根据方程式中定量关系计算生成氨气的体积;
(3)氨水溶质按氨气计算,根据c=
计算该氨水的物质的量浓度;
(2)根据方程式中定量关系计算生成氨气的体积;
(3)氨水溶质按氨气计算,根据c=
| n |
| V |
解答:
解:(1)氯化铵固体和熟石灰混合加热生成氨气、水和氯化钙,反应的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,
答:氯化铵与熟石灰反应的方程式为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑;
(2)14.8g足量熟石灰的物质的量为
=0.2mol,则:
2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O
2mol 44.8L
0.2mol V
所以V=
=4.48L,
答:生成的氨气在标准状况下的体积为4.48L;
(3)氨水溶质按氨气计算,该氨水的物质的量浓度为
=1mol/L,
答:该氨水的物质的量浓度为1mol/;
| ||
答:氯化铵与熟石灰反应的方程式为:2NH4Cl+Ca(OH)2
| ||
(2)14.8g足量熟石灰的物质的量为
| 14.8g |
| 74g/mol |
2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O
2mol 44.8L
0.2mol V
所以V=
| 0.2mol×44.8L |
| 2mol |
答:生成的氨气在标准状况下的体积为4.48L;
(3)氨水溶质按氨气计算,该氨水的物质的量浓度为
| 0.2mol |
| 0.2L |
答:该氨水的物质的量浓度为1mol/;
点评:本题考查根据方程式的计算,比较基础,侧重学生对基础知识的巩固.要注意计算格式,方程式中各量应符合上下一致,左右对应即可,即g、mol、L单位对应,题目难度不大.

练习册系列答案
相关题目
将0.1mol下列物质置于1L水中,充分搅拌后,溶液中阴离子数目最多的是( )
| A、KCl |
| B、Mg(OH)2 |
| C、Na2CO3 |
| D、NaHSO4 |
在一密闭容器中进行反应2SO2+O2?2SO3,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.3mol/L、0.15mol/L、0.3mol/L.当反应达到平衡时,可能存在的数据是( )
| A、SO2为0.6 mol/L,O2为0.3mol/L |
| B、SO2为0.4mol/L |
| C、SO3为0.6 mol/L |
| D、SO2、SO3均为0.2 mol/L |
下列说法正确的是( )
A、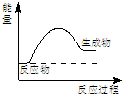 如图所示的是一个放热反应 |
| B、加入催化剂v(正)增大、v(逆)减小 |
| C、吸热反应只能在加热的条件下才能进行 |
| D、只有活化分子才能发生有效碰撞 |
下列有关工业生产的叙述正确的是( )
| A、合成氨生产过程增大氮气浓度,可以同时提高N2、H2的转化率 |
| B、硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C、电解精炼铜时,阳极溶解的金属的质量与阴极析出的金属的质量不相等 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
| A、盐酸的浓度 |
| B、铝条的表面积 |
| C、溶液的温度 |
| D、加少量Na2SO4 |
“信息”、“材料”和“能源”被称为新科技革命的三大支柱.下列有关资讯错误的是( )
| A、在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B、目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率 |
| C、2005年10月12日发射成功的“神舟六号”载人飞船使用了大量的复合材料 |
| D、合成高分子材料的广泛应用是有百利而无一害 |
不能区别三氯化铁溶液和氢氧化铁胶体的方法有( )
| A、观察颜色 |
| B、丁达尔效应 |
| C、滴加浓的氯化钠溶液 |
| D、过滤实验 |