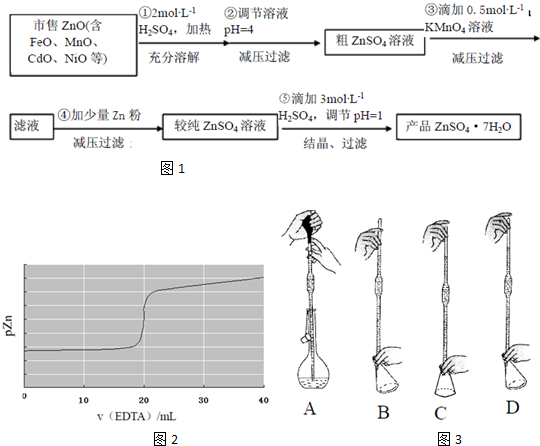
题目内容
若用镁铝合金混合物、稀硫酸、稀盐酸、NaOH溶液制取MgCl2、Al2(SO4)3溶液,
(1)先将废料加入到氢氧化钠溶液中,发生反应的离子方程式是 .
(2)过滤,将难溶物加入到 中,可得到 溶液,反应的离子方程式是 .
(3)向(2)中滤液加入适量的 ,反应的离子方程式为: .再过滤,将沉淀物加入到 中,可得到 溶液,反应的离子方程式是 .
(1)先将废料加入到氢氧化钠溶液中,发生反应的离子方程式是
(2)过滤,将难溶物加入到
(3)向(2)中滤液加入适量的
考点:镁、铝的重要化合物
专题:元素及其化合物
分析:(1)铝能溶于氢氧化钠溶液生成偏铝酸钠,镁和氢氧化钠溶液不反应;
(2)将不溶于氢氧化钠溶液的固体溶于稀盐酸制得氯化镁;
(3)偏铝酸钠和适量酸反应生成氢氧化铝,氢氧化铝和稀硫酸反应生成硫酸铝;
根据各步化学反应写出相应的反应方程式.
(2)将不溶于氢氧化钠溶液的固体溶于稀盐酸制得氯化镁;
(3)偏铝酸钠和适量酸反应生成氢氧化铝,氢氧化铝和稀硫酸反应生成硫酸铝;
根据各步化学反应写出相应的反应方程式.
解答:
解:(1)将合金废料溶于过量氢氧化钠溶液,铝和氢氧化钠溶液反应生成可溶性的偏铝酸钠,离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑,镁和氢氧化钠溶液不反应,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)过滤后得到固体Mg,将沉淀溶于稀盐酸中得到氯化镁溶液,镁和盐酸反应离子方程式为Mg+2H+═Mg2++H2↑,故答案为:稀盐酸,氯化镁,Mg+2H+═Mg2++H2↑;
(3)滤液是偏铝酸钠的溶液,加入适量稀硫酸生成氢氧化铝沉淀,离子方程式为:AlO2-+H2O+H+═Al(OH)3↓,氢氧化铝溶于稀硫酸得到硫酸铝溶液,Al(OH)3+3H+═Al3++3H2O;
故答案为:稀硫酸,AlO2-+H2O+H+═Al(OH)3↓,稀硫酸,硫酸铝,Al(OH)3+3H+═Al3++3H2O;
(2)过滤后得到固体Mg,将沉淀溶于稀盐酸中得到氯化镁溶液,镁和盐酸反应离子方程式为Mg+2H+═Mg2++H2↑,故答案为:稀盐酸,氯化镁,Mg+2H+═Mg2++H2↑;
(3)滤液是偏铝酸钠的溶液,加入适量稀硫酸生成氢氧化铝沉淀,离子方程式为:AlO2-+H2O+H+═Al(OH)3↓,氢氧化铝溶于稀硫酸得到硫酸铝溶液,Al(OH)3+3H+═Al3++3H2O;
故答案为:稀硫酸,AlO2-+H2O+H+═Al(OH)3↓,稀硫酸,硫酸铝,Al(OH)3+3H+═Al3++3H2O;
点评:本本题以镁铝为载体考查了物质的提纯及分离,根据物质的化学性质及溶解性采用适合的溶剂来分离物质,明确物质的性质是解题关键,注意分析问题的缜密性、操作方法的规范性,难度中等.

练习册系列答案
相关题目
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1mol/L,下面四个选项中能达到此目的是( )
| A、Al3+、K+、SO42-、Cl-、AlO2- |
| B、Fe2+、H+、Br-、NO3-、Cl- |
| C、Cu2+、NO3-、OH-、Cl- |
| D、Al3+、Na+、Cl-、SO42-、NO3- |
下列各组物质中,肯定是同系物的是( )
A、 和 和 |
B、CH2=CH2和 |
| C、C2H2和C4H4 |
| D、正戊烷和2-甲基丁烷 |
 已知Ⅰ.N-N键键能为167kJ?mol-1,N≡N键键能为942kJ?mol-1,
已知Ⅰ.N-N键键能为167kJ?mol-1,N≡N键键能为942kJ?mol-1,Ⅱ.N2(g)+3H2(g)═2NH3(g)△H=-92.2kJ?mol-1则反应:N4(g)+6H2(g)═4NH3(g)△H=( )
| A、+1066.4 kJ?mol-1 |
| B、-1066.4 kJ?mol-1 |
| C、+697.6 kJ?mol-1 |
| D、-697.6 kJ?mol-1 |
下列溶液中有关物质的量浓度关系正确的是( )
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
| C、物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
| D、0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
在密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.4kJ/mol,达到平衡后,下列条件都能同时提高反应速率和NO 的转化率的是( )
| A、加催化剂同时升高温度 |
| B、降低温度同时增大压强 |
| C、增大压强同时充入CO |
| D、加催化剂同时增大压强 |