题目内容
下列说法正确的是( )


| A、与铜质水龙头连接处的钢质水管不易发生腐蚀 |
| B、用电解法提取氯化铜废液中的铜,可以用碳棒连接电源的正极,另一电极用铜片 |
| C、图1中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D、图2所示装置可发生反应的离子方程式为Zn+2H+=Zn2++H2↑,且a、b电极不可能是同种材料 |
考点:原电池和电解池的工作原理
专题:
分析:A.作原电池负极的金属易被腐蚀;
B.用电解法提取氯化铜废液中的铜时,铜应作阴极,阳极是铜或惰性电极;
C.接通开关时,形成原电池,Zn为负极,pt为正极;
D.如果该装置是电解池,如锌作阴、阳极即可.
B.用电解法提取氯化铜废液中的铜时,铜应作阴极,阳极是铜或惰性电极;
C.接通开关时,形成原电池,Zn为负极,pt为正极;
D.如果该装置是电解池,如锌作阴、阳极即可.
解答:
解:A.铜、铁和电解质溶液能构成原电池,铁作负极,因为铁易失去电子而被腐蚀,故A错误;
B.电解时阳极可用铜或惰性电极(碳棒),但铜应作阴极,故B正确;
C.接通开关时,形成原电池,Zn为负极,负极上Zn的腐蚀速率加快,生成氢气的速率减慢,Pt为正极,正极上生成氢气,故C错误;
D.如果该装置是电解池,如锌作阴、阳极,电解质溶液是酸,阳极上锌失电子,阴极上氢离子得电子,符合离子反应方程式,所以两个电极可以相同,故D错误;
故选B.
B.电解时阳极可用铜或惰性电极(碳棒),但铜应作阴极,故B正确;
C.接通开关时,形成原电池,Zn为负极,负极上Zn的腐蚀速率加快,生成氢气的速率减慢,Pt为正极,正极上生成氢气,故C错误;
D.如果该装置是电解池,如锌作阴、阳极,电解质溶液是酸,阳极上锌失电子,阴极上氢离子得电子,符合离子反应方程式,所以两个电极可以相同,故D错误;
故选B.
点评:本题考查了原电池和电解池原理,同时考查学生的发散思维能力,明确正、负极和阴、阳极上发生反应的类型是解本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
茶叶中铁元素的检验可经过以下四个步骤完成:将茶叶灼烧灰化→用浓硝酸溶解茶叶灰→过滤得到的滤液→检验滤液中的Fe3+.如图是可能用到的实验用品.
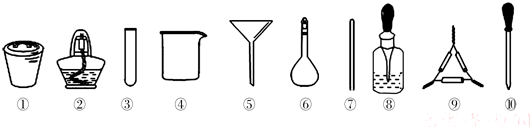
有关该实验的说法中正确的是( )

有关该实验的说法中正确的是( )
| A、第一步需选用仪器①、②和⑨,①的名称叫钳埚 |
| B、第二步用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦ |
| C、要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸 |
| D、第四步,若滤液中含有Fe3+,加入⑧中的溶液后滤液会显红色 |
 如图表示一个电解池,装有电解质溶液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解质溶液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:

