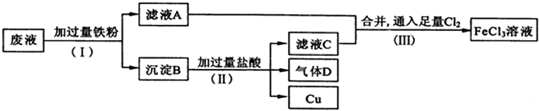
题目内容
18.已知:H2、CO、CH4、C3H8 的燃烧热分别是285.8kJ/mol、283.0kJ/mol、890.3kJ/mol、2220.0kJ/mol,则等质量的这几种气体燃烧,产生热量最多的是( )| A. | C3H8 | B. | CO | C. | H2 | D. | CH4 |
分析 △H是焓变,其值为负值时,反应放热,负号后面的数字越大,放出的热量就越大;负号后面的数字越小,放出的热量就越小,H2、CO、CH4、C3H8 的相对分子质量分别为2、28、16、44,所以相同质量的这4种燃料的物质的量之比就是:$\frac{1}{2}$:$\frac{1}{28}$:$\frac{1}{16}$:$\frac{1}{44}$,由此分析解答.
解答 解△H是焓变,其值为负值时,反应放热,负号后面的数字越大,放出的热量就越大;负号后面的数字越小,放出的热量就越小,H2、CO、CH4、C3H8 的相对分子质量分别为2、28、16、44,所以相同质量的这4种燃料的物质的量之比就是:$\frac{1}{2}$:$\frac{1}{28}$:$\frac{1}{16}$:$\frac{1}{44}$,燃烧放出热量分别为:285.8kJ×$\frac{1}{2}$=142.9kJ、283.0kJ×$\frac{1}{28}$=10.1kJ、890.3kJ×$\frac{1}{16}$=55.6KJ、2220.0kJ×$\frac{1}{44}$=50.45KJ,所以相同质量的H2、CO、CH4、C3H8 完全燃烧时,放出热量最多的是H2.
故选C.
点评 本题考查学生有关热化学方程式的计算知识,可以根据所学知识来回答,难度不大.

练习册系列答案
相关题目
8.关于 1L 0.1mol/L 的(NH4)2Fe(SO4)2溶液,下列说法正确的是( )
| A. | 和过量的 NaOH 溶液充分反应并加热,可生成标准状况下的 NH3 4.48L | |
| B. | 通入 H2S 气体,发生反应的离子方程式为:H2S+Fe2+=FeS↓+2H+ | |
| C. | Ca2+、ClO-、Cl-、Cu2+能在该溶液中大量共存 | |
| D. | Cl-、H+、I-、Na+不能在该溶液中大量共存 |
13.以下对电子转移的方向和数目的表示正确的是( )
| A. |  | B. |  | ||
| C. | 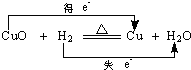 | D. |  |
3.A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示.
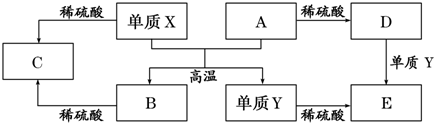
则下列说法正确的是( )

则下列说法正确的是( )
| A. | 单质Y在一定条件下能与水发生置换反应 | |
| B. | 向D溶液中滴加KSCN溶液,产生血红色沉淀 | |
| C. | X与A反应的化学方程式是 Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al | |
| D. | 由于氧化物A和B均能与酸反应所以均是碱性氧化物 |
10.下列说法正确的是(NA为阿伏加德罗常数的值)( )
| A. | 1mol OH-与1mol-OH所含质子数均为9NA | |
| B. | pH=1的H2SO4溶液含H+的数目为0.2NA | |
| C. | 273K,101kPa条件下,14g乙烯与丙烯的混合物中含有的碳原子数目为3NA | |
| D. | 标准状况下,11.2L CCl4含有C-Cl键的数目为2NA |
7.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.8g的NH4+离子中含有的电子数0.1NA | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3 NA | |
| C. | 在常温常压下,11.2LCl2含有的分子数为0.5 NA | |
| D. | 标准状况下,11.2LH2O中含有的分子数目为0.5NA |
8.下列物质中,在标准状况下,体积最大的是( )
| A. | 8gH2 | B. | 48gO2 | C. | 71gCl2 | D. | 1000gH2O |