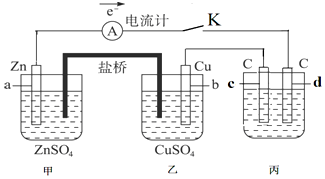
题目内容
7.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1.8g的NH4+离子中含有的电子数0.1NA | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3 NA | |
| C. | 在常温常压下,11.2LCl2含有的分子数为0.5 NA | |
| D. | 标准状况下,11.2LH2O中含有的分子数目为0.5NA |
分析 A、求出铵根离子的物质的量,然后根据铵根离子中含10个电子来分析;
B、求出二氧化硫的物质的量,然后根据1mol二氧化硫中含3mol原子来分析;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、标况下水为液体.
解答 解:A.1.8g的NH4+离子的物质的量是0.1mol,每个NH4+中含有的电子数10,共含1NA 的电子,A错误;
B. 64gSO2的物质的量为1mol,含有的原子总数为3 NA,B正确;
C.在常温常压下气体的摩尔体积不是22.4L/mol,11.2LCl2含有的分子数不为0.5 NA,C错误;
D.标准状况下,水为液体,不能根据气体的摩尔体积求算物质的量,D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
18.已知:H2、CO、CH4、C3H8 的燃烧热分别是285.8kJ/mol、283.0kJ/mol、890.3kJ/mol、2220.0kJ/mol,则等质量的这几种气体燃烧,产生热量最多的是( )
| A. | C3H8 | B. | CO | C. | H2 | D. | CH4 |
2.下列除杂试剂或操作方法不正确的是( )
| 选项 | 物质 | 杂质 | 除杂试剂或操作方法 |
| A | KNO3溶液 | KOH | 加入适量FeCl3溶液,过滤 |
| B | H2 | CO2 | 先后通过盛NaOH溶液、浓硫酸的洗气瓶 |
| C | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
| D | FeSO4溶液 | CuSO4 | 加入过量铁粉,过滤 |
| A. | A | B. | B | C. | C | D. | D |
16.在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用如图中的实验装置进行实验,证明过氧化钠可用作供氧剂.
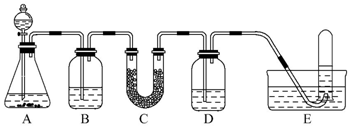
(1)A是制取CO2的装置.写出A中发生反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)填写表中空格:
(3)写出Na2O2与CO2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
(4)试管中收集满气体后,下一步实验操作及现象、结论是把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管;把带火星的木条伸入试管内,木条复燃,证明管中收集的气体是O2.

(1)A是制取CO2的装置.写出A中发生反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2中混有的HCl |
| C | ||
| D |
(4)试管中收集满气体后,下一步实验操作及现象、结论是把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管;把带火星的木条伸入试管内,木条复燃,证明管中收集的气体是O2.
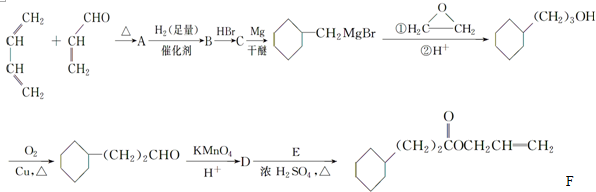
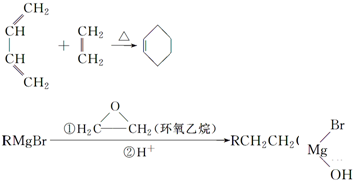

 .
. .
. .
.