题目内容
将1L含有0.4molCuSO4和0.1molNaCl的水溶液用惰性电极电解,电解一段时间后,在一个电极上得到0.25molCu,另一个电极上产生气体(标况)的体积是( )
| A、4.48L |
| B、3.36L |
| C、6.72L |
| D、13.44L |
考点:电解原理
专题:电化学专题
分析:该溶液中电解后析出0.25molCu,根据Cu2++2e-=Cu知,转移电子的物质的量为0.25mol×2=0.5mol,根据2Cl--2e-=Cl2↑知,如果氯离子完全分离需要转移电子物质的量=
×2=0.1mol<0.5mol,所以阳极上还有氢氧根离子放电,根据4OH--4e-=2H2O+O2↑知,生成n(O2)=
×1=0.1mol,再根据V=nVm计算气体体积.
| 0.1mol |
| 2 |
| 0.5mol-0.1mol |
| 4 |
解答:
解:该溶液中电解后析出0.25molCu,根据Cu2++2e-=Cu知,转移电子的物质的量为0.25mol×2=0.5mol,根据2Cl--2e-=Cl2↑知,如果氯离子完全分离需要转移电子物质的量=
×2=0.1mol<0.5mol,根据Cl原子守恒得n(Cl2)=
n(NaCl)=
×0.1mol=0.05mol,所以阳极上还有氢氧根离子放电,根据4OH--4e-=2H2O+O2↑知,生成n(O2)=
×1=0.1mol,混合气体体积V=nVm=(0.05mol+0.1mol)×22.4L/mol=3.36L,
故选B.
| 0.1mol |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.5mol-0.1mol |
| 4 |
故选B.
点评:本题以电解原理为载体考查物质的量的计算,明确阳极上析出气体成分是解本题关键,利用原子守恒、转移电子守恒解答即可,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


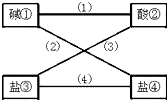 从盐酸、硫酸、石灰水、烧碱、氢氧化钡、纯碱、硝酸钠、氯化钡(均为溶液)八种物质中选出四种,使得各线条相连的物质均能发生反应且生成难溶物.
从盐酸、硫酸、石灰水、烧碱、氢氧化钡、纯碱、硝酸钠、氯化钡(均为溶液)八种物质中选出四种,使得各线条相连的物质均能发生反应且生成难溶物.