题目内容
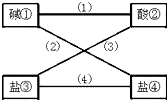 从盐酸、硫酸、石灰水、烧碱、氢氧化钡、纯碱、硝酸钠、氯化钡(均为溶液)八种物质中选出四种,使得各线条相连的物质均能发生反应且生成难溶物.
从盐酸、硫酸、石灰水、烧碱、氢氧化钡、纯碱、硝酸钠、氯化钡(均为溶液)八种物质中选出四种,使得各线条相连的物质均能发生反应且生成难溶物.(1)写出下列各物质的化学式:②
(2)写出连线(2)的化学方程式:
考点:化学基本反应类型
专题:物质的性质和变化专题,元素及其化合物
分析:根据物质间的变化规律,判断出①②③④各物质分别是谁,八种物质中硫酸与氢氧化钡反应会产生沉淀,所以符合题意的酸为硫酸,碱是氢氧化钡;硫酸与氯化钡反应有沉淀生成,所以③是氯化钡;氢氧化钡与纯碱反应有沉淀生成,所以④是纯碱.从而写出这四种物质的化学式和(2)(3)的化学方程式.
解答:
解:(1)硫酸与氢氧化钡反应会产生沉淀,故①是氢氧化钡,②是硫酸,
硫酸与氯化钡反应有沉淀生成,故③是氯化钡
氢氧化钡与纯碱反应有沉淀生成,故④是纯碱
故答案为:H2SO4; BaCl2;
(2)氢氧化钡和纯碱反应生成碳酸钡和氢氧化钠,反应方程式为Ba(OH)2+Na2CO3═BaCO3↓+2NaOH;
纯碱电离生成钠离子和碳酸根离子,电离方程式为Na2CO3═Na++CO32-.
故答案为:Ba(OH)2+Na2CO3═BaCO3↓+2NaOH;Na2CO3═Na++CO32-.
硫酸与氯化钡反应有沉淀生成,故③是氯化钡
氢氧化钡与纯碱反应有沉淀生成,故④是纯碱
故答案为:H2SO4; BaCl2;
(2)氢氧化钡和纯碱反应生成碳酸钡和氢氧化钠,反应方程式为Ba(OH)2+Na2CO3═BaCO3↓+2NaOH;
纯碱电离生成钠离子和碳酸根离子,电离方程式为Na2CO3═Na++CO32-.
故答案为:Ba(OH)2+Na2CO3═BaCO3↓+2NaOH;Na2CO3═Na++CO32-.
点评:本题考查了根据物质间的变化规律,根据各物质的性质判断即可,注意基础知识的积累.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
将1L含有0.4molCuSO4和0.1molNaCl的水溶液用惰性电极电解,电解一段时间后,在一个电极上得到0.25molCu,另一个电极上产生气体(标况)的体积是( )
| A、4.48L |
| B、3.36L |
| C、6.72L |
| D、13.44L |
下列各组物质中,只用一种试剂就能鉴别的是( )
| A、苯、己烯、己烷 |
| B、己烯、己炔、己烷 |
| C、己烯、苯、四氯化碳 |
| D、甲烷、乙烯、乙烷 |
 如图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试根据图判断M气体可能是( )
如图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试根据图判断M气体可能是( )| A、C3H4 |
| B、CO2 |
| C、CO |
| D、H2S |
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A、标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为7/22.4NA |
| B、1 mol甲基(-CH3)所含的电子总数为9NA |
| C、0.5 摩1,3-丁二烯分子中含有C=C双键数为 NA |
| D、1 mol碳正离子(CH+3)所含的电子总数为8NA |
NA为阿伏加德罗常数的数值,下列对0.3mol?L-的Na2SO4 溶液的说法中,正确的是( )
| A、0.3molNa2SO4溶于1 L水即得该溶液 |
| B、1L该溶液中含有0.6 NA个Na+和0.3NA个SO42- |
| C、1L该溶液中Na+的物质的量浓度为0.3mol?L-1 |
| D、取10L该溶液,其物质的量浓度为3mol?L-1 |
铁和水蒸气在高温条件下发生反应3Fe+4H2O(g)
Fe3O4+4H2,在此反应中水是( )
| ||
| A、氧化剂 |
| B、还原剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
常温时,等体积等物质的量浓度的下列物质的溶液中,水的电离程度由大到小顺序排列正确的是( )
①Na2CO3 ②NaHSO4 ③CH3COOH ④NaHCO3.
①Na2CO3 ②NaHSO4 ③CH3COOH ④NaHCO3.
| A、①>②>③>④ |
| B、①>④>③>② |
| C、②>①>③>④ |
| D、②>③>④>① |