题目内容
5.下列依据热化学方程式得出的结论正确的是( )| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol,则40gNaOH固体与稀盐酸完全中和,放出的热量即为57.3 kJ | |
| B. | 已知C(s)+O2(g)=CO2(g)△H1;C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,则△H1<△H2 | |
| C. | 已知H2(s)+Cl2(g)=2HCl (g)△H=-184.6 kJ/mol,则反应物总能量小于生成物总能量 | |
| D. | 已知P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定 |
分析 A、中和热不包括物质的溶解热;
B、物质完全燃烧放热多,焓变是负值;
C、根据反应物与生成物总能量相对大小判断;
D、物质能量越低越稳定.
解答 A、中和热不包括物质的溶解热,氢氧化钠固体溶解在水中要放热,故放出的热量不等于57.3kJ,故A错误;
B、已知2C(s)+2O2(g)═2CO2(g)△H1,此时碳完全燃烧,C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,此时碳不完全燃烧,且完全燃烧时碳量高,则△H1<△H2,故B正确;
C、该反应为放热反应,故反应物总能量高于生成物总能量,故C错误;
D、物质能量越低越稳定,P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定,故D错误.
故选:B.
点评 本题考查学生反应热和物质具有的能量之间的关系以及热化学方程式的意义,注意知识的归纳和应用是关键,难度中等.

练习册系列答案
相关题目
15.下列说法不正确的是( )
| A. | 海水淡化的方法主要有电渗析法、蒸馏法、离子交换法等 | |
| B. | 大部分金属的冶炼都是通过在高温下发生的氧化还原反应实现的 | |
| C. | 臭氧和氧气成键方式相同,打雷闪电时,会有少量氧气转化为臭氧 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
16.下列化学反应的离子方程式正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2 SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| C. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O |
13.0.02mol•L-1的HCN溶液与0.02mol•L-1 NaCN溶液等体积混合,已知混合溶液中pH>7,则下列关系中,正确的是( )
| A. | c(Na+)>c(CN-)>c(H+)>c(OH-) | B. | c(HCN)+c(CN-)=0.04 mol•L-1 | ||
| C. | c(Na+)+c(H+)=c(CN-)+c(OH-) | D. | c(CN-)>c(HCN) |
10.25℃时将0.02mol/L Ba(OH)2溶液100mL和0.01mol/L H2SO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液( )
| A. | pH=13 | |
| B. | pH=2 | |
| C. | 由水电离出的c(H+)=0.01 mol/L | |
| D. | 溶质的物质的量浓度为0.005 mol/L |
17.生活或实验中常碰到一些化学知识,下列分析中不正确的是( )
| A. | 人体不能缺碘,需要正常补碘.“加碘食盐”中的“碘”是指碘元素 | |
| B. | 进行焰色反应实验时,蘸取样品之前需要用稀硫酸溶液清洗铂丝 | |
| C. | “绿色化学”的理想在于不再使用有毒、有害的物质,不再产生废物 | |
| D. | 水壶中产生的水垢可用食醋清洗除去 |
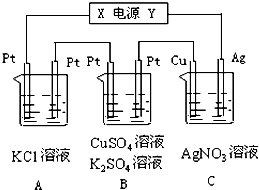 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答: