题目内容
13.下列物质组成元素间电负性差值可能大于1.8的化合物是( )| A. | CH4 | B. | CO | C. | NO2 | D. | Na2O |
分析 一般来说元素电负性的差值大于1.7时,原子间形成离子键,小于1.7时,原子间形成共价键,根据对应化合物的晶体类型判断电负性,以此解答.
解答 解:一般来说元素电负性的差值大于1.7时,原子间形成离子键,小于1.7时,原子间形成共价键,则组成元素间电负性差值可能大于1.8的化合物应是离子化合物,只有D符合.
故选D.
点评 本题考查了电负性的含义和应用,侧重考查学生的分析能力,题目难度不大,注意一般情况下电负性的变化规律与元素非金属性的变化规律一致.

练习册系列答案
相关题目
12.表是有机物A、B的有关信息.
根据表中信息回答下列问题:
(1)A的名称是:乙烯
(2)写出在一定条件下,A生成高分子化合物的化学反应方程式 .
.
(3)B的名称为:苯.B与乙苯互为同系物.其中乙苯的同分异构体还3 种.写出其中一种的物质名称邻二甲苯(或间二甲苯或对二甲苯).
| A | B |
| ②使溴的四氯化碳溶液褪色; ②比例模型为: 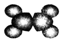 ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成; ②球棍模型为: 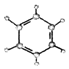 |
(1)A的名称是:乙烯
(2)写出在一定条件下,A生成高分子化合物的化学反应方程式
 .
.(3)B的名称为:苯.B与乙苯互为同系物.其中乙苯的同分异构体还3 种.写出其中一种的物质名称邻二甲苯(或间二甲苯或对二甲苯).
13.下列液体均处于25℃,有关叙述中,正确的是( )
| A. | 某溶液中水电离出的c(H+)=10-13,则该溶液的pH一定为13 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 | |
| C. | pH相同的氨水与盐酸等体积混合,所得溶液pH<7 | |
| D. | pH=7的CH3COOH与CH3COONa混合溶液中,c(Na+)=c(CH3COO-) |
18.下列溶液中,微粒浓度关系正确的是( )
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)<c(OH-) | |
| B. | pH=6的醋酸与醋酸钠的混合溶液中,c(Na+)>c(CH3COO-) | |
| C. | 0.1 mol/L 的Na2S溶液中,c(OH)=c(H+)+c(HS-)+2c(H2S) | |
| D. | pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中,一定是c(OH-)=c(H+) |
2.某化学实验小组同学向用大理石和稀盐酸制备CO2后的残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示.下列有关说法不正确的是( )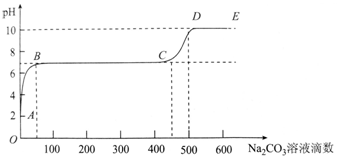

| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | AB发生的反应为:Ca2++CO32-═CaCO3↓ | |
| D. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) |
3.有关于化学实验的操作或者说法中,正确的是( )
| A. | 用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低 | |
| B. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| C. | 将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷 | |
| D. | 将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖 |
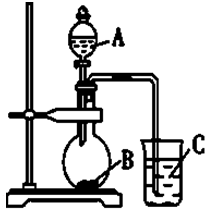
 .
.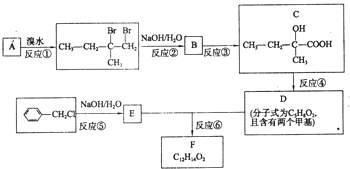 分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线.
分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线.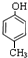 .
.