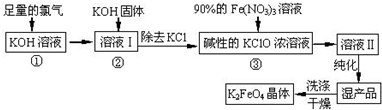
题目内容
10.用下列方法制取氢气.反应速率最大的是( )| A. | 粉末Zn与2mol•L-1硫酸溶液反应 | B. | 粉末状Mg与2mol•L-1硫酸溶液反应 | ||
| C. | 粉末状Na与2mol•L-1硫酸溶液反应 | D. | 粉末状Al与2mol•L-1硫酸溶液反应 |
分析 反应物浓度越大、温度越高、反应物接触面积越大时化学反应速率越大,外界因素只是影响因素,决定物质反应速率的是物质本身的性质,据此分析解答.
解答 解:这几种制取氢气的方法中硫酸浓度相同,只有金属不同,金属越活泼,金属与酸反应速率越快,金属活动性强弱顺序是C>B>D>A,所以反应速率大小顺序是C>B>D>A,
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,明确化学反应速率影响因素、决定因素是解本题关键,侧重考查学生分析判断能力,题目难度不大.

练习册系列答案
相关题目
20.在下列反应中:A2(g)+B2(g)?2AB(g)△H<0当其达到平衡时,在如图所示的曲线中,符合勒夏特列原理的是( )
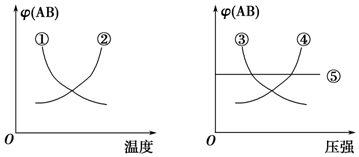

| A. | ①② | B. | ③④ | C. | ①④ | D. | ①⑤ |
18.相同质量的两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出氢气的体积之比为( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:6 |
19.将m g钠和铝的混合物放入盛有足量的水的烧杯中,反应停止后,烧杯中有n g固体.下列说法正确的是( )
| A. | m≥n | B. | 所得溶液中的溶质是NaAlO2、NaOH | ||
| C. | 固体是Al(OH)3 | D. | 固体是单质铝 |
20.以下转化过程可以一步实现的是( )
| A. | SO2→H2SO4 | B. | SiO2→H2SiO3 | C. | Al2O3→Al(OH)3 | D. | Fe2O3→Fe(OH)3 |