题目内容
1.原电池是一种将化学能转化成电能的装置.由铜、锌和稀硫酸组成的原电池中,负极是Zn,发生氧化反应,电极反应是Zn-2e-=Zn2+,正极是Cu,总的反应式(离子方程式)是Zn+2H+=Zn2++H2↑.电流方向是从Cu极到Zn极.分析 根据原电池的定义分析;根据原电池中活泼金属为负极发生失电子的氧化反应,不活泼的金属为正极发生得电子的还原反应,原电池中电流从正极流向负极,据此分析.
解答 解:原电池是把化学能转变为电能的装置;在Cu、Zn和稀硫酸组成的原电池中,锌失电子变成离子进入溶液,发生氧化反应,所以锌是负极,电极反应式为Zn-2e-=Zn2+.铜片上氢离子得电子发生还原反应,所以铜是正极,电极反应式为2H++2e-=H2↑;则电池的总反应为Zn+2H+=Zn2++H2↑;电流方向是从Cu极到Zn极.
故答案为:化学;电;Zn;氧化;Zn-2e-=Zn2+;Cu;Zn+2H+=Zn2++H2↑;Cu;Zn.
点评 本题考查原电池的正负极的判断及电极反应式,注意根据氧化还原反应得失电子判断原电池的正负极,题目较简单.

练习册系列答案
相关题目
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4LCl2溶于水,Cl2和水反应时转移电子数为NA | |
| B. | 标准状况下,40gSO3中含有分子的数目为0.5NA | |
| C. | 标准状况下,2.24L由乙烯和聚乙烯组成的混合物中含有原子的数目为0.6NA | |
| D. | 常温常压下,10g46%酒精水溶液中含氧原子总数为0.1NA |
12.由乙醇及必要的无机试剂合成乙二醇,其依次发生的反应类型为( )
| A. | 取代,消去,加成 | B. | 加成,消去,取代 | C. | 消去,加成,取代 | D. | 取代,加成,消去 |
9.除去下列各组物质中的杂质,所用试剂不适当的是( )
| A. | Fe粉中混有Cu粉杂质--稀硫酸 | B. | FeCl3溶液中混有FeCl2杂质--Cl2 | ||
| C. | Cu粉中混有CuO杂质--H2 | D. | FeCl2溶液中混有FeCl3杂质--Cu |
13.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)B元素处于元素周期表中三周期ⅢA族;
(2)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素;
(3)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式);
(4)C、E形成的化合物为SO2、SO3(填化学式).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(2)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素;
(3)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式);
(4)C、E形成的化合物为SO2、SO3(填化学式).
10.用下列方法制取氢气.反应速率最大的是( )
| A. | 粉末Zn与2mol•L-1硫酸溶液反应 | B. | 粉末状Mg与2mol•L-1硫酸溶液反应 | ||
| C. | 粉末状Na与2mol•L-1硫酸溶液反应 | D. | 粉末状Al与2mol•L-1硫酸溶液反应 |
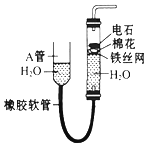 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空: A.B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去).
A.B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去).