题目内容
20.在下列反应中:A2(g)+B2(g)?2AB(g)△H<0当其达到平衡时,在如图所示的曲线中,符合勒夏特列原理的是( )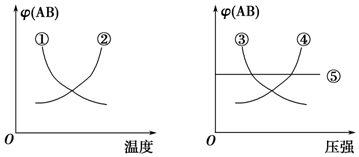
| A. | ①② | B. | ③④ | C. | ①④ | D. | ①⑤ |
分析 该反应正反应是放热反应,升高温度平衡向逆反应移动,AB%降低;该反应反应前后气体的体积不变,增大压强,平衡不移动,AB%不变,结合图象AB%与温度、压强变化选择.
解答 解:该反应正反应是放热反应,升高温度平衡向逆反应移动,AB%降低,由左图可知,曲线①符合变化;
该反应反应前后气体的体积不变,增大压强,平衡不移动,AB%不变,由右图可知,曲线⑤符合变化;
故选D.
点评 本题考查外界条件对化学平衡的影响、化学平衡图象等,比较基础,注意理解平衡移动原理.

练习册系列答案
相关题目
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4LCl2溶于水,Cl2和水反应时转移电子数为NA | |
| B. | 标准状况下,40gSO3中含有分子的数目为0.5NA | |
| C. | 标准状况下,2.24L由乙烯和聚乙烯组成的混合物中含有原子的数目为0.6NA | |
| D. | 常温常压下,10g46%酒精水溶液中含氧原子总数为0.1NA |
12.由乙醇及必要的无机试剂合成乙二醇,其依次发生的反应类型为( )
| A. | 取代,消去,加成 | B. | 加成,消去,取代 | C. | 消去,加成,取代 | D. | 取代,加成,消去 |
9.除去下列各组物质中的杂质,所用试剂不适当的是( )
| A. | Fe粉中混有Cu粉杂质--稀硫酸 | B. | FeCl3溶液中混有FeCl2杂质--Cl2 | ||
| C. | Cu粉中混有CuO杂质--H2 | D. | FeCl2溶液中混有FeCl3杂质--Cu |
10.用下列方法制取氢气.反应速率最大的是( )
| A. | 粉末Zn与2mol•L-1硫酸溶液反应 | B. | 粉末状Mg与2mol•L-1硫酸溶液反应 | ||
| C. | 粉末状Na与2mol•L-1硫酸溶液反应 | D. | 粉末状Al与2mol•L-1硫酸溶液反应 |
 ,HCN中C的化合价为-2.
,HCN中C的化合价为-2.
 ;F、G、M三种元素最高价氧化物对应的水化物碱性最强的是Ca(OH)2(填化学式).
;F、G、M三种元素最高价氧化物对应的水化物碱性最强的是Ca(OH)2(填化学式).