题目内容
13.如图所示:黑色固体A有以下转化关系,每个方框表示有一种反应或生成物(反应条件及生成的水已略去),其中C、F常温下为无色气体,D、E有共同的阳离子.
(1)写出B和C的化学式:BFeSO4,CH2S
(2)写出反应①、②、④的离子方程式
①FeS+2H+=H2S↑+Fe2+
②2Fe2++Cl2=2Fe3++2Cl-
④2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
分析 C、F是常温下无色气体,而且根据题意C燃烧生成F,可见C是可燃性气体;D、E具有共同的阳离子,可见B中的阴离子不是Cl-,G则可能是稀硫酸且B中阳离子与D、E中阳离子都属于同一种有变价的金属元素,故为Fe,结合转化关系可知,A为FeS,G为H2SO4,B为FeSO4,C为H2S,D为FeCl3,E为Fe2(SO4)3,F为SO2 .
解答 解:C、F是常温下无色气体,而且根据题意C燃烧生成F,可见C是可燃性气体;D、E具有共同的阳离子,可见B中的阴离子不是Cl-,G则可能是稀硫酸且B中阳离子与D、E中阳离子都属于同一种有变价的金属元素,故为Fe,结合转化关系可知,A为FeS,G为H2SO4,B为FeSO4,C为H2S,D为FeCl3,E为Fe2(SO4)3,F为SO2 .
(1)由上述分析可知,B和C的化学式分别为:FeSO4、H2S,
故答案为:FeSO4;H2S;
(2)反应①的离子方程式为:FeS+2H+=H2S↑+Fe2+,
反应②的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
反应④的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:FeS+2H+=H2S↑+Fe2+;2Fe2++Cl2=2Fe3++2Cl-;2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评 本题考查无机物推断,基本属于猜测验证型题目,需要学生熟练掌握元素化合物知识,注意充分挖掘题目中的信息,难度中等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
3.NaF、NaI、MgO晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是( )
| 物质 | NaF | NaI | MgO |
| 离子所带电荷数 | 1 | 1 | 2 |
| 离子核间距离/10-10m | 2.31 | 3.18 | 2.10 |
| A. | NaF>NaI>MgO | B. | MgO>NaF>NaI | C. | MgO>NaI>NaF | D. | NaI>NaF>MgO |
4.下列实验中,不能观察到明显现象的是( )
| A. | 把氯气通入到氯化亚铁溶液中 | B. | 把绿豆大的钾投入无水乙醇中 | ||
| C. | 把碘化钾溶液滴入淀粉溶液中 | D. | 把乙烯通入溴水中 |
1.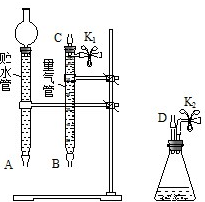 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
(1)现有以下仪器和用品:橡胶管、秒表、温度计、a mol/L 稀硝酸、b mol/L 稀硝酸及图中仪器.
①写出本实验的化学方程式:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,并标出电子转方向和数目: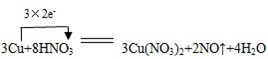 .
.
②设计实验方案:在相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度下,测定相同时间内产生气体体积(或产生相同体积的气体所需的时间).
③在如图中将 A、B、C、D、几处用橡胶管以正确方式连接起来,以测定反应所产生气体的体积(三个容器中的液体和水都已出).
④测定前,为避免 NO 被氧化为 NO2,要用 CO2排出锥形瓶和橡胶管中的空气:在锥形瓶中加入铜片后松开 K2弹簧夹,从 K2处的橡胶管向装置中通入 CO2,此时 K1处应进行的操作是松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止,则空气已排尽.
(2)注入稀硝酸后,在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间 t1、t2、t3;收集气体体积 V1、V2.请完成表:
 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.(1)现有以下仪器和用品:橡胶管、秒表、温度计、a mol/L 稀硝酸、b mol/L 稀硝酸及图中仪器.
①写出本实验的化学方程式:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,并标出电子转方向和数目:
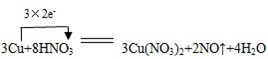 .
.②设计实验方案:在相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度下,测定相同时间内产生气体体积(或产生相同体积的气体所需的时间).
③在如图中将 A、B、C、D、几处用橡胶管以正确方式连接起来,以测定反应所产生气体的体积(三个容器中的液体和水都已出).
④测定前,为避免 NO 被氧化为 NO2,要用 CO2排出锥形瓶和橡胶管中的空气:在锥形瓶中加入铜片后松开 K2弹簧夹,从 K2处的橡胶管向装置中通入 CO2,此时 K1处应进行的操作是松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止,则空气已排尽.
(2)注入稀硝酸后,在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间 t1、t2、t3;收集气体体积 V1、V2.请完成表:
| 实验编号 | 稀硝酸的浓度 /(mol/L) | 稀硝酸的体积 /mL | 温度 /℃ | 时间 /min | 收集气体的体积/mL |
| ① | a | V | 25 | t1 | V1 |
| ② | V | ||||
| ③ | V |
8.某无色透明溶液中,由水电离出来的[H+]=1×10-11 mol•L-1,该溶液中一定能大量共存离子组是( )
| A. | K+、Na+、MnO4-、NO3- | B. | K+、Na+、Cl-、NO3- | ||
| C. | NH4+、AlO2-、Na+、CH3COO- | D. | Fe3+、S2-、Al3+、HCO3- |
18.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加C的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 使体积不变,充水蒸气使体系压强增大 | |
| D. | 使压强不变,充氮气使容器体积增大 |
5.对于反应CaH2+2H2O═Ca(OH)2+2H2↑有下列判断正确的是( )
| A. | H2只是氧化产物 | B. | H2O是氧化剂 | ||
| C. | CaH2中的H元素被还原 | D. | CaH2是氧化剂 |
2.根据转化关系判断下列说法正确的是( )


| A. | 反应①中(C6H10O5)n可表示淀粉或纤维素 | |
| B. | 反应②属于氧化反应 | |
| C. | 将在空气中灼烧后的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 |