题目内容
13.现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大.已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族.请回答下列问题:(1)元素B在周期表中的位置第2周期ⅣA族,M的空间构型是三角锥形.
(2)A、D、E三种元素组成一种常见化合物,该化合物的电子式为
 ,
,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
(4)M、N均能结合H+,其中结合H+能力较强的是NH3(填化学式),用离子方程式证明NH3+H3O+═NH4++H2O.
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是S2-+H2O?HS-+OH-(用离子方程式表示).常温下7.8g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式2Na2O2(s)+2H2O(1)═4NaOH(aq)+O2(g)△H=-20Q kJ/mol.
分析 A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大,D是地壳中含量最多的元素,所以D是氧元素;D与G同主族,所以G是硫元素;A分别与C、D可形成含有10个电子的共价化合物M、N,所以A为氢元素,C为氮元素,M为NH3,N为H2O;A与E主族,E、F、G、H同周期,所以E为钠元素,H为氯元素;B的最外层电子数是其电子层数的2倍,所以B为碳元素;F位于B的前一主族,结合原子序数可知F为铝元素.
解答 解:A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大,D是地壳中含量最多的元素,所以D是氧元素;D与G同主族,所以G是硫元素;A分别与C、D可形成含有10个电子的共价化合物M、N,所以A为氢元素,C为氮元素,M为NH3,N为H2O;A与E主族,E、F、G、H同周期,所以E为钠元素,H为氯元素;B的最外层电子数是其电子层数的2倍,所以B为碳元素;F位于B的前一主族,结合原子序数可知F为铝元素.
(1)B为碳元素,处于周期表中第2周期ⅣA族,M为NH3,为三角锥形结构,
故答案为:第2周期ⅣA族;三角锥形;
(2)A、D、E三种元素组成一种常见化合物为NaOH,该化合物的电子式为 ,工业上电解饱和食盐水生成氢氧化钠与氯气,该反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
,工业上电解饱和食盐水生成氢氧化钠与氯气,该反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为: ;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(3)E、F元素的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(4)发生反应:NH3+H3O+═NH4++H2O,说明NH3结合H+能力比H2O强,
故答案为:NH3;NH3+H3O+═NH4++H2O;
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,则X、Y分别为Na2O2和Na2S,其中Na2S的水溶液由于硫离子水解而使溶液显碱性,其离子方程式为S2-+H2O?HS-+OH-;
常温下7.8g Na2O2(即为0.1mol),与水反应放出Q kJ热量(Q>0),则2molNa2O2与水反应放出20Q kJ的热,所以该反应的热化学方程式为:2Na2O2(s)+2H2O(1)═4NaOH(aq)+O2(g)△H=-20Q kJ/mol,
故答案为:S2-+H2O?HS-+OH-;2Na2O2(s)+2H2O(1)═4NaOH(aq)+O2(g)△H=-20Q kJ/mol.
点评 本题考查元素化合物推断、元素化合物组成与性质、常用化学用语等,是对基础知识的综合运用,难度中等.

| A. | 8g O2 | B. | 0.3mol NaCl | ||
| C. | 标准状况下4.48L CH4 | D. | 含有3.01×1022个氧原子的H2SO4 |
| A. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 漂白粉的成分为次氯酸钙 | |
| D. | SO2可用于漂白食品 |
①过渡金属配合物远比主族金属配合物多
②Cu(H2O)42+中的Cu2+提供空轨道,H2O中的氧原子提供孤对电子形成配位键,1mol该配合物中含有σ键的数目为6NA
③配位化合物中必定存在配位键
④配位键仅存在于配位化合物中.
| A. | ①②④ | B. | ①④ | C. | ①③ | D. | ①②③ |
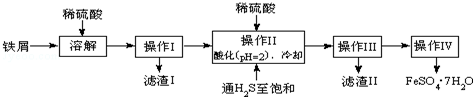
查询资料,得有关物质的数据如下:
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(2)操作Ⅱ中,通入硫化氢至饱和的目的是:①除去溶液中的Sn2+离子;②防止Fe2+被氧化;③在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤洗涤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)常温下,Ksp[Fe(OH)2]=1.64×10-14,则求得反应:Fe2++2H2O?Fe(OH)2+2H+的平衡常数为:6.1×10-15(保留1位小数).
| A. | SO2可用于杀菌、消毒,但不可用来加工食品 | |
| B. | 液氨汽化时要吸收大量热,因此氨常用作制冷剂 | |
| C. | 二氧化硅与水不反应,说明二氧化硅不是酸性氧化物 | |
| D. | 铝箔在酒精灯上加热铝熔化但不滴落,说明氧化铝的熔点高于铝的熔点 |
| A. | 氢氧化钠晶体 | B. | 硫酸亚铁晶体 | C. | 浓硫酸 | D. | 浓盐酸 |
 .
.