题目内容
18.外界条件对可逆反应速率的影响(以N2+3H2?2NH3;△H<0为例)(1)减压:v(正)减小,v(逆)减小.
(2)增加(N2的浓度):v(正)增大,v(逆)增大.
(3)T、P一定,充人稀有气体:v(正)减小,v(逆)减小.
(4)T、V一定,充人稀有气体:v(正)不变,v(逆)不变.
(5)使用催化剂:v(正)增大,v(逆)增大.
分析 (1)减压正逆反应速率都减小;
(2)增加反应物的浓度正逆反应速率都加快;
(3)T、P一定,充人稀有气体,体积变大,相当于减小压强;
(4)T、V一定,充人稀有气体,反应体系各组分的浓度不变;
(5)使用催化剂,正逆反应速率都加快.
解答 解:(1)减压正逆反应速率都减小,所以v(正)减小,v(逆)减小,故答案为:减小;减小;
(2)增加反应物的浓度正逆反应速率都加快,所以v(正)增大,v(逆)增大,故答案为:增大;增大;
(3)T、P一定,充人稀有气体,体积变大,相当于减小压强,所以v(正)减小,v(逆)减小,故答案为:减小;减小;
(4)T、V一定,充人稀有气体,反应体系各组分的浓度不变,所以正逆反应速率不变,故答案为:不变;不变;
(5)使用催化剂,正逆反应速率都加快,所以v(正)增大,v(逆)增大,故答案为:增大;增大.
点评 本题考查外界条件对化学反应速率的影响,学生要清楚外界条件越强反应速率越快,特别要注意T、P一定,充人稀有气体和T、V一定,充人稀有气体,导致反应速率的变化.

练习册系列答案
相关题目
9.一定温度下,在一固定体积的密闭容器中进行可逆反应A(s)+2B(g)?3C(g),下列说法能表明反应已达最大限度的是( )
①C的生成速率和C的分解速率相等;
②单位时间内生成a mol A,同时生成2a mol B;
③气体密度不再变化;
④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为1:3:2.
①C的生成速率和C的分解速率相等;
②单位时间内生成a mol A,同时生成2a mol B;
③气体密度不再变化;
④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为1:3:2.
| A. | ②④⑤ | B. | ①③④ | C. | ①② | D. | ①②③⑤ |
13.说法正确的是( )
| A. | 所有过渡元素都是金属元素 | |
| B. | CaO2和CaCl2含有的化学键类型完全相同 | |
| C. | 非金属原子之间不可能形成离子键 | |
| D. | 有化学键断裂的过程一定属于化学变化 |
9.某有机物在氧气里充分燃烧,生成的CO2和H2O的物质的量之比为1:1,由此可以得出该有机物( )
| A. | 分子中C、H、O的个数之比为1:2:3 | B. | 分子中肯定不含氧原子 | ||
| C. | 分子中C和H的个数之比为1:2 | D. | 分子中可能含有氧原子 |
10.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 标准状况下,22.4 L苯中含有的分子数目为NA | |
| B. | 常温常压下,28g乙烯中含有碳碳双键数目为NA | |
| C. | 0.5mol•L-1K2SO4溶液中含有K+数目为NA | |
| D. | 28g铁与足量氯气反应失去的电子数目为NA |
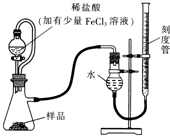 过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量. .
.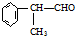 的物质,该物质是一种香料.
的物质,该物质是一种香料.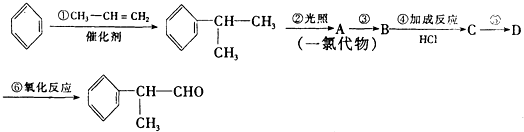
 .
. +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2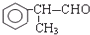 +2H2O.
+2H2O.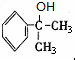 生成
生成 、
、 、
、 .
.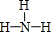 ;它的另一种氢化物R2H4是一种火箭燃料的成分,其电子式是
;它的另一种氢化物R2H4是一种火箭燃料的成分,其电子式是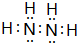 .
.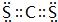 .
.