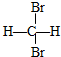题目内容
5.Na2S溶液盛装在带橡胶塞的试剂瓶中,仔细闻有臭鸡蛋气味,请用离子方程式解释:S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-.分析 有臭鸡蛋气味,说明又硫化氢气体生成,原因是硫化钠溶液中硫离子分步水解生成少量硫化氢,据此写出水解的离子方程式.
解答 解:硫化钠溶液中硫离子分步水解生成少量硫化氢,水解的离子方程式分别为:S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-,
故答案为:S2-+H2O?HS-+OH-;HS-+H2O?H2S+OH-.
点评 本题考查了盐的水解原理及其应用,题目难度不大,明确盐的水解原理为解答关键,试题侧重基础知识的考查,注意掌握水解离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
20.下列A、B、C、D、E、F为几种常见仪器的部分结构(有的仪器被放大)
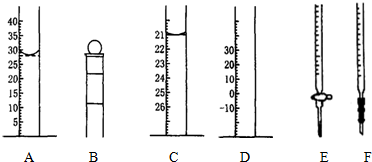
(1)A图中液面所示溶液的体积为28.0mL
(2)仪器E的名称是酸式滴定管
(3)Na2S2O3(硫代硫酸钠),俗称大苏打.把Na2S2O3•5H2O固体溶于水,得到无色溶液,该溶液显碱性,用离子反应方程式解释溶液显碱性的原因:S2O32?+5H2O?HS2O3?+0H?.化工生产中常常依据反应2S2O32-+I2=S4O62-+2I-,用I2的标准溶液测定大苏打产品的纯度.步骤如下:
①称取5.5g Na2S2O3•5H2O产品,用仪器B(从上述A、B、C、D、E、F中选填)配制成100.00mL溶液.
②用仪器F(从上述A、B、C、D、E、F中选填)量取10.00mL溶液于锥形瓶中,以淀粉溶液为指示剂.
③用浓度为0.0500mol/L的I2标准溶液进行滴定,判断达到滴定终点的现象是锥形瓶中的溶液由无色溶液变成蓝色,且半分钟不褪色.
④重复滴定3次,数据记录于表.计算所配制的Na2S2O3溶液的物质的量浓度为(保留4位小数)0.2000mol/L
⑤滴定时若用Na2S2O3溶液润洗锥形瓶,则测得大苏打产品的浓度偏高(填偏高、偏低、不变).

(1)A图中液面所示溶液的体积为28.0mL
(2)仪器E的名称是酸式滴定管
(3)Na2S2O3(硫代硫酸钠),俗称大苏打.把Na2S2O3•5H2O固体溶于水,得到无色溶液,该溶液显碱性,用离子反应方程式解释溶液显碱性的原因:S2O32?+5H2O?HS2O3?+0H?.化工生产中常常依据反应2S2O32-+I2=S4O62-+2I-,用I2的标准溶液测定大苏打产品的纯度.步骤如下:
①称取5.5g Na2S2O3•5H2O产品,用仪器B(从上述A、B、C、D、E、F中选填)配制成100.00mL溶液.
②用仪器F(从上述A、B、C、D、E、F中选填)量取10.00mL溶液于锥形瓶中,以淀粉溶液为指示剂.
③用浓度为0.0500mol/L的I2标准溶液进行滴定,判断达到滴定终点的现象是锥形瓶中的溶液由无色溶液变成蓝色,且半分钟不褪色.
④重复滴定3次,数据记录于表.计算所配制的Na2S2O3溶液的物质的量浓度为(保留4位小数)0.2000mol/L
| 编号 | 1 | 2 | 3 | 4 |
| Na2S2O3溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 20.01 | 20.02 |
17.氨气分子的立体构型是三角锥形,而甲烷是正四面体形,这是因为( )
| A. | 两种分子的中心原子的杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 | |
| B. | NH3分子中氮原子形成3个杂化轨道,CH4分子中碳原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 | |
| D. | 氨气分子是四原子化合物,甲烷为五原子化合物 |
14.下列有关有机物结构的说法中正确的是( )
| A. | CH2═CH2分子中6个原子都共面,而CH3CH═CH2分子中最多有7个原子共面 | |
| B. | 苯是平面正六边形分子,其中存在单双键交替的结构 | |
| C. | 正戊烷分子中的碳原子之间以碳碳单键结合成直线状 | |
| D. | CH3Cl没有同分异构体说明CH4是正四面体结构,而非平面正方形 |
15.研究发现,NO在人体的血管系统内具有传送信号的功能,因而有“信使分子”的誉称.下列有关NO的说法正确的是( )
| A. | NO不属于大气污染物 | B. | NO能溶于水 | ||
| C. | NO易与空气中的氧气化合 | D. | NO可用排空气法收集 |
 看如图完成下面的填空,写出电极反应式和总反应式.
看如图完成下面的填空,写出电极反应式和总反应式. J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素. ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族. ,R、T的氢化物的稳定强的HCl(填化学式)
,R、T的氢化物的稳定强的HCl(填化学式)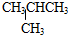
 和
和