题目内容
10.20.6gNaR含有Na+ 0.2mol,则NaR的摩尔质量为103g/mol,则含R8.0g的NaR的物质的量为0.1mol.分析 根据n=$\frac{m}{M}$结合物质的构成解答该题.
解答 解:20.6gNaR含有Na+ 0.2mol,则n(NaR)=0.2mol,M(NaR)=$\frac{20.6g}{0.2mol}$=103g/mol,M(R)=103g/mol-23g/mol=80g/mol,
含R8.0g的NaR的物质的量为n(NaR)=n(R)=$\frac{8.0g}{80g/mol}$=0.1mol,
故答案为:103;0.1.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握构成特点以及相关计算公式的运用,难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
20.利用煤化工所得的苯可合成甲苯、乙苯、环己烷其反应如图,下列说法正确的是( )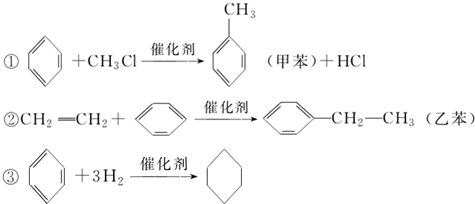

| A. | 反应①、②、③加成反应 | |
| B. | 溴水中加入苯,二者可发生取代反应 | |
| C. | 乙苯中所有碳原子一定在同一平面上 | |
| D. | 能用溴水判断反应②所得的乙苯中是否混有乙烯 |
1.用于检验火柴头燃烧可产生SO2的装置正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
18.在某无色溶液中,可能存在Na+、Ca2+、Fe3+、Br-、CO32-、SO42-、Cl-中的几种.某同学进行了下列实验:
①取少量原溶液,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,将溶液分为2份;
②一份中加入AgNO3溶液,有白色沉淀产生;
③另一份加入BaCl2溶液,有白色沉淀产生.
则该溶液中一定大量存在的离子组是( )
①取少量原溶液,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,将溶液分为2份;
②一份中加入AgNO3溶液,有白色沉淀产生;
③另一份加入BaCl2溶液,有白色沉淀产生.
则该溶液中一定大量存在的离子组是( )
| A. | Na+、Fe3+、SO42- | B. | CO32-、Cl-、SO42- | C. | Ca2+、Br-、SO42- | D. | Na+、SO42-、CO32- |
5.下列各反应中转移电子数为2NA的是( )
| A. | 22.4L氯气与足量的铜充分反应 | B. | 0.2mol浓硫酸与足量铜反应 | ||
| C. | 46g金属钠与足量的水反应 | D. | 56g铁与足量稀硝酸溶液反应 |
1.下列表达正确的是( )
| A. | 氧族元素包括氧、硫、锡、碲、钋 | |
| B. | Na2O2固体中的阳离子和阴离子个数比为1:1 | |
| C. | H、D、T、H+可以用来表示氢元素的四种同位素 | |
| D. | 表示金属元素名称的汉字不一定都含“钅”旁 |
6.已知16S和34Se位于同一主族,下列关系正确的是( )
| A. | 热稳定性:HF>HCl>H2Se | B. | 原子半径:Br>Se>Cl | ||
| C. | 还原性:I->Se2->Cl- | D. | 酸性:HBrO4>H2SeO4>HClO4 |
 .
.