题目内容
17.氨气分子的立体构型是三角锥形,而甲烷是正四面体形,这是因为( )| A. | 两种分子的中心原子的杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 | |
| B. | NH3分子中氮原子形成3个杂化轨道,CH4分子中碳原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 | |
| D. | 氨气分子是四原子化合物,甲烷为五原子化合物 |
分析 NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,氨气分子空间构型是三角锥形;CH4分子中C原子采取sp3型杂化杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,为正四面体构型.
解答 解:NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,N-H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形;CH4分子中C原子采取sp3型杂化杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,C-H之间的键角相等为109°28′,故CH4为正四面体构型,故ABD错误,C正确.
故选C.
点评 考查了分子空间构型的判断,难度中等,注意理解价层电子对互斥理论与杂化轨道理论.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.用于检验火柴头燃烧可产生SO2的装置正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
12.化学无处不在,下列与化学相关的说法不正确的是( )
| A. | 碘是人体必需微量元素,所以应多吃富含高碘酸的食物 | |
| B. | “血液透析”运用了胶体的性质 | |
| C. | 过氧化钠可作为高空飞行或潜水装置中的供氧剂 | |
| D. | 大力开发太阳能、风能、水能等新能源,减少煤、石油等化石燃料的使用,有利于实现“低碳经济” |
2.下列叙述中,错误的是( )
| A. | 只含非极性键的纯净物一定是单质 | B. | 只含极性键的纯净物一定是化合物 | ||
| C. | 离子化合物中一定有离子键 | D. | 纯净物中一定存在化学键 |
9.如表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
(1)⑦的最低负价是-2;⑧的最高价含氧酸的化学式为HClO4.
(2)①和⑦两种元素的原子按1:1组成的常见化合物的电子式为 .
.
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+).
(4)⑤、⑥的单质中更容易与①的单质反应的是N2.
(5)②、④的最高价氧化物的水化物之间发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)用电子式表示③和⑨组成的化合物的形成过程 .
.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
(2)①和⑦两种元素的原子按1:1组成的常见化合物的电子式为
 .
.(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+).
(4)⑤、⑥的单质中更容易与①的单质反应的是N2.
(5)②、④的最高价氧化物的水化物之间发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)用电子式表示③和⑨组成的化合物的形成过程
 .
.
6.已知16S和34Se位于同一主族,下列关系正确的是( )
| A. | 热稳定性:HF>HCl>H2Se | B. | 原子半径:Br>Se>Cl | ||
| C. | 还原性:I->Se2->Cl- | D. | 酸性:HBrO4>H2SeO4>HClO4 |
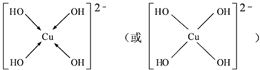 .
.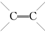 的化合物与CH2═CH2一样,在一定条件下可聚合成高分子化合物.
的化合物与CH2═CH2一样,在一定条件下可聚合成高分子化合物.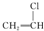 聚合而成的,其化学方程式是
聚合而成的,其化学方程式是 .
.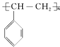 ),它是由
),它是由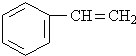 (写结构简式)聚合而成的.
(写结构简式)聚合而成的.