题目内容
9. 看如图完成下面的填空,写出电极反应式和总反应式.
看如图完成下面的填空,写出电极反应式和总反应式.(1)Fe电极是负(填“正”或“负”)极,其电极反应为Fe-2e-=Fe2+,该反应是氧化(填“氧化”或“还原”)反应;
(2)Cu电极是正极,其电极反应为2H++2e-=H2↑,该反应是还原反应.
(3)电池总反应的离子方程式为Fe+2H+=Fe2++H2↑.
分析 Cu、Fe和稀硫酸构成原电池中,Fe失电子发生氧化反应作负极,电极反应为Fe-2e-=Fe2+,Cu为正极,正极上氢离子得电子发生还原反应,电极反应为2H++2e-=H2,总反应为Fe+2H+=Fe2++H2↑.
解答 解:(1)Cu、Fe和稀硫酸构成原电池中,Fe失电子发生氧化反应作负极,电极反应为Fe-2e-=Fe2+,
故答案为:负;Fe-2e-=Fe2+;氧化;
(2)Cu、Fe和稀硫酸构成原电池中,Fe失电子作负极,Cu为正极,正极上氢离子得电子发生还原反应,则其正极的电极反应为:2H++2e-=H2↑;
故答案为:正;2H++2e-=H2↑;还原;
(3)根据反应原理知,电池总反应为Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑.
点评 本题考查了原电池原理,掌握电极的判读和电极方程式书写,侧重于基本原理应用的考查,题目难度不大,注意基础知识的积累.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
20.利用煤化工所得的苯可合成甲苯、乙苯、环己烷其反应如图,下列说法正确的是( )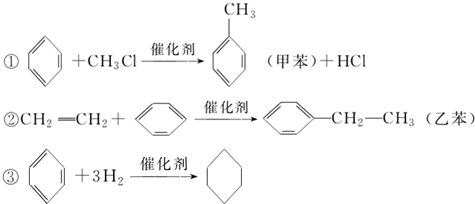

| A. | 反应①、②、③加成反应 | |
| B. | 溴水中加入苯,二者可发生取代反应 | |
| C. | 乙苯中所有碳原子一定在同一平面上 | |
| D. | 能用溴水判断反应②所得的乙苯中是否混有乙烯 |
17.有A、B、C、D、E五种短周期元素,其元素特征信息如表:
回答下列问题:(1)写出下列元素的名称:C钠,E氯.
(2)写出A、B、C形成的化合物的电子式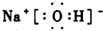 .
.
(3)①写出E单质与A、B、C形成的化合物反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O.
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式:2Al+2H2O+2OH-═2AlO2-+3H2↑.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(2)写出A、B、C形成的化合物的电子式
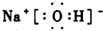 .
.(3)①写出E单质与A、B、C形成的化合物反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O.
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式:2Al+2H2O+2OH-═2AlO2-+3H2↑.
4.下列有机物在核磁共振氢谱图上只有一组峰的是( )
| A. | CH3COOCH3 | B. | CH3OH | C. | HCOOH | D. | HCHO |
14.下列有关电池的说法中不正确的是( )
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 充电电池可以无限制地反复使用 | |
| C. | 甲醇燃料电池可把化学能转化为电能 | |
| D. | 废旧电池不能乱扔,需回收处理 |
1.用于检验火柴头燃烧可产生SO2的装置正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
18.在某无色溶液中,可能存在Na+、Ca2+、Fe3+、Br-、CO32-、SO42-、Cl-中的几种.某同学进行了下列实验:
①取少量原溶液,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,将溶液分为2份;
②一份中加入AgNO3溶液,有白色沉淀产生;
③另一份加入BaCl2溶液,有白色沉淀产生.
则该溶液中一定大量存在的离子组是( )
①取少量原溶液,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,将溶液分为2份;
②一份中加入AgNO3溶液,有白色沉淀产生;
③另一份加入BaCl2溶液,有白色沉淀产生.
则该溶液中一定大量存在的离子组是( )
| A. | Na+、Fe3+、SO42- | B. | CO32-、Cl-、SO42- | C. | Ca2+、Br-、SO42- | D. | Na+、SO42-、CO32- |
 ;
;