题目内容
3.将32g铜与600mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:标况下,NO和NO2的体积各为多少L?分析 铜与浓硝酸反应生成NO2气体,随着反应的进行,浓硝酸变为稀硝酸,铜与稀硝酸反应生成NO气体,计算混合气体总物质的量、Cu的物质的量,结合电子转移守恒列方程计算NO和NO2的物质的量,再根据V=nVm计算各自体积.
解答 解:与浓硝酸反应生成NO2气体,随着反应的进行,浓硝酸变为稀硝酸,铜与稀硝酸反应生成NO气体,
n(NO2)+n(NO)=V/Vm=$\frac{11.2L}{22.4L/mol}$=0.5mol,
Cu的物质的量为$\frac{32g}{64g/mol}$=0.5mol,
设NO2为xmol,NO为ymol,则:x+y=0.5
根据电子转移守恒:x+3y=0.5×2,
联立方程,解得x=y=0.25
所以V(NO2)=0.25mol×22.4L/mol=5.6L
V(NO)=0.25mol×22.4L/mol=5.6L
答:NO和NO2的体积各为5.6L.
点评 本题考查化学方程式计算,注意利用原子电子转移守恒解答,熟练掌握元素化合物性质.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
13.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24LCl2溶于足量水中转移电子的数目为0.1NA | |
| B. | 标准状况下,22.4L苯中含有双键的数目为3NA | |
| C. | 常温下,16gO2和O3的混合气体中含有氧原子的数目为NA | |
| D. | 25℃时,pH=1的醋酸溶液中含有H+的数目为0.1NA |
11.将9g铜和铁的混合物投入100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO.则下列说法正确的是( )
| A. | 第一次剩余4.8 g金属为铜和铁 | |
| B. | 稀硝酸的物质的量浓度为1.0 mol•L-1 | |
| C. | 原混合物中铜和铁各0.075 mol | |
| D. | 再加入上述100 mL稀硝酸,又得到标准状况下1.12 L NO |
8.下列金属最易与H2O发生反应的是( )
| A. | Na | B. | K | C. | Al | D. | Mg |
12.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 16 g CH4与18 g NH4+所含的质子数均为10NA | |
| B. | 将15.6 g Na2O2投入到足量水中,反应后溶液中的氧原子数为0.4NA | |
| C. | 在1 L 0.1 mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.1NA | |
| D. | 2 mol NO和1 mol O2混合,所得气体的分子数为2NA |
13.下列有关胶体与溶液的叙述错误的是( )
| A. | 都是混合物 | B. | 胶体比溶液更隐定 | ||
| C. | 都属于分散系 | D. | 用丁达尔效应区分胶体与溶液 |
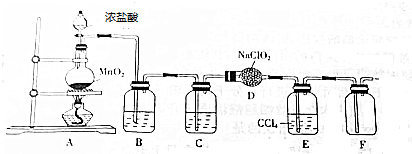
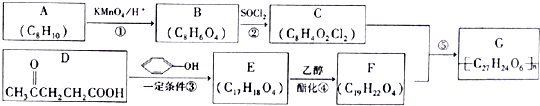
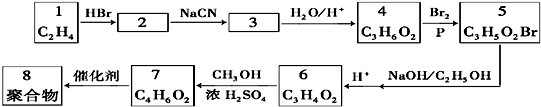
 →
→ +HCl
+HCl ;
;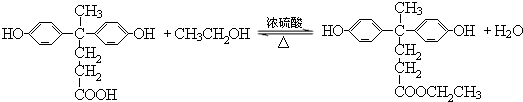 .
.