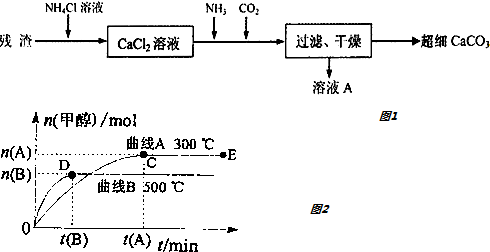
题目内容
14.ClO2的漂白能力和消毒能力比氯气强且使用安全,实验室制备ClO2的装置如图所示(已知常温下ClO2是一种易溶于水儿难溶于有机溶剂的气体).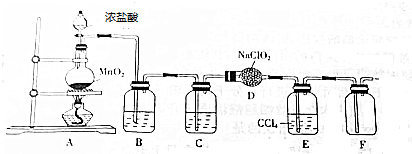
(1)装置A产生的Cl2经除杂,干燥后与装置D中的NaClO2反应可制得ClO2气体,装置A中发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,装置B中的试剂是饱和食盐水,装置C中的试剂是浓硫酸,装置D中发生反应的化学方程式为2NaClO2+Cl2═2ClO2+2NaCl;
(2)仪器D的名称是球形干燥管,装置E的作用是除去ClO2中的未反应的Cl2;
(3)改装置存在着一个明显的缺陷是缺尾气吸收装置;
(4)工业上制取ClO2所需的原料之一,Cl2可以通过海水提镁获得,实验室模拟海水提镁制取镁和Cl2时,可采用石墨作为阳极(填“阴”或“阳”),不锈钢作另一个点击,电解熔融状态的MgCl2获得.
分析 由题目中所给信息和实验装置图可知:本实验首先用浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,生成的氯气中混有HCl和水,为制备纯净干燥的氯气,根据氯气不溶于饱和食盐水的性质,可用饱和食盐水除去气体中混有的HCl杂质,B装置:除去气体中混有的HCl杂质,C装置:然后用浓硫酸干燥除去水,经除杂、干燥后在D中亚氯酸钠固体反应生成ClO2,由于Cl2易溶于CCl4液体,E用于除去ClO2中的未反应的Cl2,最后用向上排空法收集.
(1)实验室用浓盐酸和MnO2在加热条件下反应制备Cl2;B装置:除去气体中混有的HCl杂质,C装置:然后用浓硫酸干燥除去水,D中亚氯酸钠固体反应生成ClO2;
(2)仪器D的名称是球形干燥管,生成的ClO2中混有氯气,为制备纯净干燥的ClO2,根据氯气易溶于四氯化碳,使用四氯化碳来除去氯气,所以装置E的作用是除去ClO2中的未反应的Cl2;
(3)F后应连接尾气吸收装置;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,电解时石墨作阳极.
解答 解:(1)装置A中浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,生成的氯气中混有HCl和水,为制备纯净干燥的氯气,根据氯气不溶于饱和食盐水的性质,可用饱和食盐水除去气体中混有的HCl杂质,B装置:除去气体中混有的HCl杂质,C装置:然后用浓硫酸干燥除去水,经除杂、干燥后在D中亚氯酸钠固体反应2NaClO2+Cl2═2ClO2+2NaCl,生成ClO2,
故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;饱和食盐水;浓硫酸;2NaClO2+Cl2═2ClO2+2NaCl;
(2)仪器D有球形的显著特征为球形,所以其名称是球形干燥管,常温下ClO2是一种易溶于水,难溶于有机溶剂的气体,生成的ClO2中混有氯气,为制备纯净干燥的ClO2,使用四氯化碳来除去氯气,所以装置E的作用是除去ClO2中的未反应的Cl2,
故答案为:球形干燥管;除去ClO2中的未反应的Cl2;
(3)用排空气法收集二氧化氯,排出的空气中含有二氧化氯,需用尾气吸收装置,ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,
故答案为:缺尾气吸收装置;
(4)电解熔融状态下的无水MgCl2制取金属镁,阴极上镁离子放电生成单质镁,所以电解时石墨作阳极,不锈钢作阴极,熔融状态下,通电后会产生Mg和Cl2,方程式为:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,
故答案为:阳;熔融.
点评 本题考查了氯气、ClO2的制取及其性质,题目难度中等,学习中注意把握化学实验基本操作,做该类题目时把握实验目的和实验原理是解答题目的关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 常温下,0.1 mol碳酸钠晶体中含有CO32-的个数为0.1NA | |
| B. | 标准状况下22.4 L H2O所含分子数为NA | |
| C. | 1 L 0.5 mol•L-1 CH3COOH溶液中,CH3COO-的个数为0.5NA | |
| D. | 在NO、NO2的混合气体22.4 L中,含有的氮原子数为NA个 |
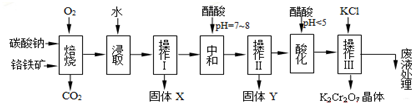
已知:①4FeO•Cr2O3+8Na2CO3+7O2═8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3═2NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是过滤.
(2)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl,该反应在溶液中能发生的理由是K2CrO7的溶解度比Na2Cr2O7小.
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量NaOH溶液(填写试剂)、溶解、过滤、再通入足量CO2气体、…、灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26n}{17m}$×100%(用含m、n的代数式表示).
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min.然后加入100mL水,加入3mL淀粉指示剂,用0.1000mol/LNa2S2O3标准溶液滴定.若实验中共用去Na2S2O3标准溶液47.40mL,则所得产品中重铬酸钾的纯度为92.9%.(保留3位有效数字)已知:①K2Cr2O7的摩尔质量为294g/mol
②Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
I2+2S2O32-═2I-+S4O62-.
| A. | 把浓硝酸放在棕色瓶中,并置于冷暗处保存 | |
| B. | 把Na保存在煤油中 | |
| C. | 把NaOH溶液放在带橡皮塞的玻璃瓶中 | |
| D. | 把氢氟酸放在玻璃瓶中 |