题目内容
现有A、B、C、D四种元素,它们的质子数依次增多.
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
(1)写出C、D的名称:C ;
(2)A在周期表中的位置
(3)写出B2A3与氢氧化钠溶液反应的离子方程式 .
(4)比较B、C二种元素形成的简单离子半径的大小(用离子符号表示):离子半径: .
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
(1)写出C、D的名称:C
(2)A在周期表中的位置
(3)写出B2A3与氢氧化钠溶液反应的离子方程式
(4)比较B、C二种元素形成的简单离子半径的大小(用离子符号表示):离子半径:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体,则A为氧元素;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱,则B为铝元素;
③B为铝元素,C+离子比B3+离子多8个电子,则C为钾元素;
④C与D元素可以形成化合物CD,⑤CD的溶液中通入氯气后加淀粉溶液显蓝色,则D为碘元素;C为钾元素,据此来回答;
(2)根据元素周期表的编排原则来回答;
(3)三氧化二铝是两性氧化物,可以和强碱氢氧化钠之间反应生成偏铝酸钠和水;
(4)微粒半径大小比较方法:先看电子层,电子层越多,半径越大,电子层一样,看核电荷数,核电荷数越多,半径越小.
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱,则B为铝元素;
③B为铝元素,C+离子比B3+离子多8个电子,则C为钾元素;
④C与D元素可以形成化合物CD,⑤CD的溶液中通入氯气后加淀粉溶液显蓝色,则D为碘元素;C为钾元素,据此来回答;
(2)根据元素周期表的编排原则来回答;
(3)三氧化二铝是两性氧化物,可以和强碱氢氧化钠之间反应生成偏铝酸钠和水;
(4)微粒半径大小比较方法:先看电子层,电子层越多,半径越大,电子层一样,看核电荷数,核电荷数越多,半径越小.
解答:
解:①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体,则A为氧元素;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱,则B为铝元素;
③B为铝元素,C+离子比B3+离子多8个电子,则C为钾元素;
④C与D元素可以形成化合物CD,⑤CD的溶液中通入氯气后加淀粉溶液显蓝色,则D为碘元素;C为钾元素,
(1)C是钾,D是碘,故答案为:钾;碘;
(2)A为氧元素,在周期表中的位置:第二周期,第VIA族,故答案为:第二周期第VIA族;
(3)三氧化二铝是两性氧化物,可以和强碱氢氧化钠之间反应生成偏铝酸钠和水,即Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)电子层越多,半径越大,所以离子半径:K+>Al3+,故答案为:K+>Al3+.
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱,则B为铝元素;
③B为铝元素,C+离子比B3+离子多8个电子,则C为钾元素;
④C与D元素可以形成化合物CD,⑤CD的溶液中通入氯气后加淀粉溶液显蓝色,则D为碘元素;C为钾元素,
(1)C是钾,D是碘,故答案为:钾;碘;
(2)A为氧元素,在周期表中的位置:第二周期,第VIA族,故答案为:第二周期第VIA族;
(3)三氧化二铝是两性氧化物,可以和强碱氢氧化钠之间反应生成偏铝酸钠和水,即Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)电子层越多,半径越大,所以离子半径:K+>Al3+,故答案为:K+>Al3+.
点评:本题以元素推断为载体,考查考查元素周期表的结构、元素以及化合物的性质,推断元素是关键,注意基础知识的掌握.

练习册系列答案
相关题目
下列四种离子混合时不会发生反应的是( )
| A、OH-、Ca2+、CO32-、Cu2+ |
| B、Na+、Cl-、Mg2+、Fe3+ |
| C、H+、HCO3-、Al3+、CO32- |
| D、Ba2+、OH-、SO42-、NH4+ |
化学与社会、生活密切相关,下列说法中不正确的是( )
| A、区别地沟油(加工过的餐饮废弃油)和矿物油(汽油、煤油、柴油等)的方法是加入足量氢氧化钠溶液共热,不分层的是地沟油 |
| B、发泡塑料饭盒不适于盛放含油较多的食品 |
| C、光化学烟雾的产生与汽车排放的尾气有关 |
| D、将废电池深埋,可以避免其中的重金属污染 |
下列叙述中,不正确的是( )
| A、0.1 mol?L-1CH3COOH溶液加水稀释,n(H+)增大 |
| B、0.2 mol?L-1盐酸与等体积0.05 mol?L-1Ba(OH)2溶液混合后,溶液pH为1 |
| C、向含等浓度的KCl和KI的混合溶液,滴加少量AgNO3溶液生成黄色沉淀,说明同温度下Ksp(AgCl)大于Ksp(AgI) |
| D、若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则c(NH4HSO4)<c(NH4NO3)<c(NH4HCO3) |
下列事实不能证明HNO2是弱电解质的是( )
| A、常温下NaNO2溶液的pH大于7 |
| B、常温下0.1 mol?L-1 HNO2溶液的pH=2.1 |
| C、用HNO2溶液做导电实验,灯泡很暗 |
| D、常温下pH=2的HNO2溶液稀释至100倍,pH约为3.1 |

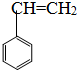 ;②CH3-CH=CH-CH3; ③CH2=CH-CH=CH2;④CH≡C-CH3;⑤
;②CH3-CH=CH-CH3; ③CH2=CH-CH=CH2;④CH≡C-CH3;⑤
 在如图用石墨作电极的电解池中,放入500mLCuSO4溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mLCuSO4溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量.请回答下列问题: