题目内容
下列叙述中,不正确的是( )
| A、0.1 mol?L-1CH3COOH溶液加水稀释,n(H+)增大 |
| B、0.2 mol?L-1盐酸与等体积0.05 mol?L-1Ba(OH)2溶液混合后,溶液pH为1 |
| C、向含等浓度的KCl和KI的混合溶液,滴加少量AgNO3溶液生成黄色沉淀,说明同温度下Ksp(AgCl)大于Ksp(AgI) |
| D、若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则c(NH4HSO4)<c(NH4NO3)<c(NH4HCO3) |
考点:弱电解质在水溶液中的电离平衡,pH的简单计算,盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A、醋酸加水稀释促进电离;
B、酸碱混合溶液呈酸性,但是混合后溶液的体积不知道无法计算;
C、Ksp越小,溶解度越小,越易生成沉淀;
D、根据c(NH4+)相等时,铵根离子的水解程度越大,则溶液的浓度越大.
B、酸碱混合溶液呈酸性,但是混合后溶液的体积不知道无法计算;
C、Ksp越小,溶解度越小,越易生成沉淀;
D、根据c(NH4+)相等时,铵根离子的水解程度越大,则溶液的浓度越大.
解答:
解:A、醋酸加水稀释促进电离,所以0.1 mol?L-1CH3COOH溶液加水稀释,醋酸的电离平衡正移,n(H+)增大,故A正确;
B、由于反应后酸剩余,所以酸碱混合溶液呈酸性,但是混合后溶液的体积不知道无法计算,故B错误;
C、Ksp越小,溶解度越小,越易生成沉淀,所以向含等浓度的KCl和KI的混合溶液,滴加少量AgNO3溶液生成黄色沉淀,说明同温度下Ksp(AgCl)大于Ksp(AgI),故C正确;
D、当c(NH4+)相等时,铵根离子的水解程度越大,则溶液的浓度越大,已知NH4HCO3中铵根离子和碳酸氢根离子发生相互促进的水解,水解程度较大,NH4HSO4溶液中氢离子抑制铵根离子的水解,铵根离子水解程度较小,NH4NO3溶液中发生一般的水解,所以水解程度NH4HCO3溶液>NH4NO3溶液>NH4HSO4溶液,所以c(NH4HSO4)<c(NH4NO3)<c(NH4HCO3),故D正确;
故选B.
B、由于反应后酸剩余,所以酸碱混合溶液呈酸性,但是混合后溶液的体积不知道无法计算,故B错误;
C、Ksp越小,溶解度越小,越易生成沉淀,所以向含等浓度的KCl和KI的混合溶液,滴加少量AgNO3溶液生成黄色沉淀,说明同温度下Ksp(AgCl)大于Ksp(AgI),故C正确;
D、当c(NH4+)相等时,铵根离子的水解程度越大,则溶液的浓度越大,已知NH4HCO3中铵根离子和碳酸氢根离子发生相互促进的水解,水解程度较大,NH4HSO4溶液中氢离子抑制铵根离子的水解,铵根离子水解程度较小,NH4NO3溶液中发生一般的水解,所以水解程度NH4HCO3溶液>NH4NO3溶液>NH4HSO4溶液,所以c(NH4HSO4)<c(NH4NO3)<c(NH4HCO3),故D正确;
故选B.
点评:本题考查了弱电解质的电离,Ksp的应用,水解原理的应用等,侧重于反应原理应用的考查,题目难度中等.

练习册系列答案
相关题目
下列各组离子在溶液中能大量共存的是( )
| A、Na+、Fe3+、I-、SCN- |
| B、H+、NH4+、NO3-、CH3COO- |
| C、K+、Ba2+、Cl-、Br- |
| D、Ag+、NO3-、CO32-、Al3+ |
在月球上发现水被美国《科学》杂志评为2009年十大科学突破之一.下列化学反应中水作还原剂的是( )
| A、CaO+H2O=Ca(OH)2 |
| B、2Na+2H2O=2NaOH+H2↑ |
| C、Cl2+2H2O=HCl+HClO |
| D、2F2+2H2O=4HF+O2 |
NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A、标准状况下,2.24LH2O含有的分子数等于0.1NA |
| B、20g重水(D2 O)所含的电子数为10NA |
| C、标准状况下,2.24LCl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA |
| D、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
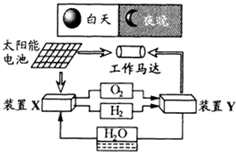 如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )| A、二氧化硅是太阳能电池的光电转换材料 |
| B、装置Y中正极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的氢气和氧气再生 |
| D、装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
下列有关电池叙述正确的是( )
| A、化学电池的反应本质是复分解反应 |
| B、铅蓄电池放电时,是电能转变为化学能的过程 |
| C、锌锰干电池碳棒是负极,锌片是正极 |
| D、锌锰干电池工作一段时间后锌外壳逐渐变薄 |
