题目内容
按照无机物的分类方法,下列物质中前者属于碱,后者属于碱性氧化物的是( )
| A、纯碱、氧化铜 |
| B、烧碱、干冰 |
| C、熟石灰、氧化镁 |
| D、氢氧化镁、氧化铝 |
考点:酸、碱、盐、氧化物的概念及其相互联系
专题:物质的分类专题
分析:碱是指电离时生成的阴离子全部是氢氧根离子的化合物;
碱性氧化物是指能和酸反应生成盐和水的氧化物;据此分析.
碱性氧化物是指能和酸反应生成盐和水的氧化物;据此分析.
解答:
解:A、纯碱即碳酸钠属于盐,氧化铜属于碱性氧化物,故A错误;
B、烧碱即NaOH属于碱,干冰即二氧化碳属于酸性氧化物,故B错误;
C、熟石灰即氢氧化钙属于碱,氧化镁属于碱性氧化物,故C正确;
D、氢氧化镁属于碱,氧化铝属于两性氧化物,故D错误;
故选C.
B、烧碱即NaOH属于碱,干冰即二氧化碳属于酸性氧化物,故B错误;
C、熟石灰即氢氧化钙属于碱,氧化镁属于碱性氧化物,故C正确;
D、氢氧化镁属于碱,氧化铝属于两性氧化物,故D错误;
故选C.
点评:本题考查了物质的分类,题目难度不大,注意把握有关的概念,属于基础知识的考查.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
在25℃,101Kpa下由HCHO(g)、H2和CO组成的混合气体共4.0g,其相对氢气的密度为20,将该气体与3.36L氧气(标准状况)充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为( )
| A、等于4.0g |
| B、大于4.0g |
| C、小于4.0g |
| D、无法确定 |
在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(g)+3B(g)?2C(g)+D(g) 已达平衡状态的是( )
| A、混合气体的压强不随时间变化 |
| B、B的生成速率和D的生成速率1:1 |
| C、混合气体的密度不随时间变化 |
| D、D的分子数之比为3:2:1. |
M、N为短周期的两种元素,M元素原子的最外层电子数≤4,N元素原子的最外层电子数>4,下列对其中说法正确的是( )
| A、M、N可能为金属 |
| B、若M、N为同周期元素,则原子半径M<N |
| C、M、N元素的单质可能与水发生置换反应 |
| D、M、N形成的离子化合物不能体现强氧化性 |
下列工业制备的反应原理选择不恰当的是( )
A、制乙醇:CH3CHO+H2
| ||||
B、制盐酸:H2+Cl2
| ||||
C、制烧碱:2NaCl+2H2O
| ||||
| D、湿法冶炼铜:Fe+CuSO4=Cu+FeSO4 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
| B、标准状况下,2.24 L Cl2与过量NaOH溶液反应,转移的电子总数为0.2NA |
| C、1 mol/L的NaOH溶液中含Na+数目为NA |
| D、标准状况下,11.2 L CCl4中的C-Cl键数目为2NA |
下列实验方案合理的是( )
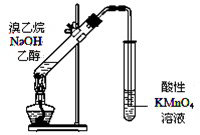

| A、鉴别苯和甲苯:分别加入溴水振荡 |
| B、检验酒精中的少量水:向酒精中加入无水硫酸铜 |
| C、制备纯净的氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 |
| D、证明溴乙烷与NaOH醇溶液共热生成乙烯:用如图所示的实验装置 |
在298K下,铅室法生产硫酸存在如下三个平衡:下列有关说法正确的是( )
①SO2(g)+NO2(g)?SO3(g)+NO(g)△H1=-10.0kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H2=-27.3kJ?mol-1
③2SO2(g)+O2(g)?2SO3(g)△H3.
①SO2(g)+NO2(g)?SO3(g)+NO(g)△H1=-10.0kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H2=-27.3kJ?mol-1
③2SO2(g)+O2(g)?2SO3(g)△H3.
| A、298K,反应③的△H3═+47.3 kJ?mol-1 |
| B、平衡时,其他条件不变,升高温度,反应①中正反应速率加快 |
| C、平衡时,其他条件不变,增大NO2浓度可增大反应③中SO2转化率 |
| D、反应③中,每有1mol O=O键断裂,同时生成2molSO3,则该反应达平衡状态 |
下列物质的熔点高低顺序正确的是( )
| A、金刚石>碳化硅>晶体硅 |
| B、氧化铝>氯化钾>氯化钠 |
| C、H2O>NH3>PH3>AsH3 |
| D、SiC>生铁>纯铁>Mg |