题目内容
下列工业制备的反应原理选择不恰当的是( )
A、制乙醇:CH3CHO+H2
| ||||
B、制盐酸:H2+Cl2
| ||||
C、制烧碱:2NaCl+2H2O
| ||||
| D、湿法冶炼铜:Fe+CuSO4=Cu+FeSO4 |
考点:化学的发展趋势,氯碱工业,金属冶炼的一般原理
专题:化学应用
分析:工业上制备的要求是物质原料要丰富且价廉,反应条件易控制,生成的物质易分离,满足这些要求的就可以.
解答:
解:A、工业制备乙醇,葡萄糖在酒化酶催化剂作用下分解C6H12O6
2C2H5OH+2CO2生成乙醇和二氧化碳,故A错误;
B、工业上制备盐酸,利用氢气在氯气中燃烧生成的气体通入水中生成,故B正确;
C、工业上制备烧碱(NaOH),电解饱和食盐水,同时收集两极产生的气体,故C正确;
D、湿法冶炼铜,是利用铁的还原性强于铜的还原性,用铁把铜从可溶性铜盐溶液中置换出来,即Fe+CuSO4=Cu+FeSO4,故D正确.
故选:A.
| 催化剂 |
B、工业上制备盐酸,利用氢气在氯气中燃烧生成的气体通入水中生成,故B正确;
C、工业上制备烧碱(NaOH),电解饱和食盐水,同时收集两极产生的气体,故C正确;
D、湿法冶炼铜,是利用铁的还原性强于铜的还原性,用铁把铜从可溶性铜盐溶液中置换出来,即Fe+CuSO4=Cu+FeSO4,故D正确.
故选:A.
点评:本题考查了工业制取原理,要注意工业制取的条件和实验室制取的不同,平常接触的实验室制取较多,注意区分,别混淆.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
下列除去杂质的方法正确的是( )
| A、除去CO2气体中混有的HCl气体:用NaOH溶液洗气后干燥 |
| B、除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤、晒干 |
| C、除去FeSO4溶液中混有的CuSO4:加入过量铁粉,过滤 |
| D、除去KClO3固体中混有的KCl:加水溶解,过滤 |
下列说法正确的是( )
| A、摩尔是七个基本物理量之一 |
| B、在化学反应中,反应前各物质的“物质的量”之和与反应后个物质的“物质的量”之和一定相等 |
| C、氢氧化钠的摩尔质量是40g |
| D、标准状况下,H2的摩尔体积约为22.4L/mol |
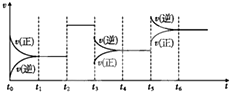 某密闭容器中发生反应:X(g)+Y(g)?3Z(g)△H<0如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生反应:X(g)+Y(g)?3Z(g)△H<0如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )| A、t2时加入了催化剂 |
| B、t3时降低了温度 |
| C、t5时增大了压强 |
| D、t4~t5时间内转化率最低 |
把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒接近液体细流时,细流可能发生偏转的是( )
| A、CCl4 |
| B、CH3CH2OH |
| C、CS2 |
| D、苯( C6H6 ) |
按照无机物的分类方法,下列物质中前者属于碱,后者属于碱性氧化物的是( )
| A、纯碱、氧化铜 |
| B、烧碱、干冰 |
| C、熟石灰、氧化镁 |
| D、氢氧化镁、氧化铝 |
下列措施不能使0.1mol/L的醋酸溶液导电性增强的是( )
| A、加水 |
| B、加氯化钠晶体 |
| C、加NaOH固体 |
| D、通NH3 |
已知:
①向KClO3晶体中滴加浓盐酸,产生黄绿色气体.
②向NaI溶液中通入少量实验①产生的气体,溶液变黄色.
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断正确的是( )
①向KClO3晶体中滴加浓盐酸,产生黄绿色气体.
②向NaI溶液中通入少量实验①产生的气体,溶液变黄色.
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断正确的是( )
| A、实验①证明Cl-具有氧化性 |
| B、实验②中氧化剂与还原剂的物质的量之比为2:1 |
| C、实验③说明KI被氧化 |
| D、上述实验证明氧化性:ClO3->Cl2>I2 |
下表为某有机物分别与各种试剂反应的现象,则这种有机物可能是( )
| 试剂 | 钠 | 酸性高锰酸钾溶液 | NaHCO3溶液 |
| 现象 | 放出气体 | 褪色 | 不反应 |
| A、CH2═CH-COOH |
| B、CH2═CHCH3 |
| C、CH3COOCH2CH3 |
| D、CH2═CHCH2OH |