题目内容
10.下列大小判断正确的是( )| A. | 第一电离能:N>O | B. | 第一电子亲和能:F<Cl | ||
| C. | 电负性:O<Cl | D. | 共价键的键角:NH3<H2S |
分析 A.N的2p电子半满为稳定结构;
B.元素处于基态时的气态原子获得1个电子成为-1价阴离子时所放出的能量叫做该元素的第一电子亲和能,非金属性越强,元素得电子能力越强,其电子亲和能越大;
C.非金属性越强,电负性越大;
D.氨气为三角锥型,NH3分子中共价键键角为107°,H2S分子中共价键键角接近90°,为V型.
解答 解:A.N的2p电子半满为稳定结构,难失去电子,则第一电离能:N>O,故A正确;
B.非金属性越强,元素得电子能力越强,其电子亲和能越大,则第一电子亲和能:F>Cl,故B错误;
C.非金属性越强,电负性越大,则电负性:O>Cl,故C错误;
D.氨气为三角锥型,NH3分子中共价键键角为107°,H2S分子中共价键键角接近90°,为V型,则共价键的键角:NH3>H2S,故D错误;
故选A.
点评 本题考查元素的性质,为高频考点,把握电子排布规律、电负性的比较方法等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
3.含6.02×1024个中子的188O的质量是( )
| A. | 18g | B. | 16g | C. | 8g | D. | 10g |
5.测定胆矾结晶水含量的操作中,正确的是( )
| A. | 加热晶体时先用小火,后渐改为用大火加热至晶体变白 | |
| B. | 灼烧时如有晶体溅出容器,应再加一些晶体继续加热 | |
| C. | 加热后的冷却放在干燥器中进行 | |
| D. | 加热、冷却、称量,重复多次即是恒重操作 |
19.向2.0L恒容密闭容器中充入1.0mol PCl5,在温度为T时发生如下反应PCl5(g)?PCl3(g)+Cl2(g)△H=+124kJ•mol-1.反应过程中测定的部分数据见表:
回答下列问题:(1)反应在前50s的平均速率v(PCl5)=0.0016mol/(L•s)
(2)温度为T时,该反应的化学平衡常数=0.025
(3)上述反应到达平衡状态时,PCl3的体积分数为16.7%
要提高平衡时PCl3的体积分数,可采取的措施有CD
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
(2)温度为T时,该反应的化学平衡常数=0.025
(3)上述反应到达平衡状态时,PCl3的体积分数为16.7%
要提高平衡时PCl3的体积分数,可采取的措施有CD
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.

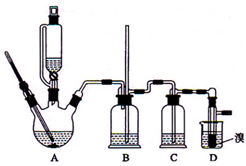 实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应:CH2=CH2+Br2→BrCH2CH2Br.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:
实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应:CH2=CH2+Br2→BrCH2CH2Br.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题: