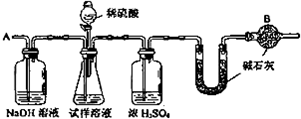
题目内容
6.浓硫酸和铜在加热时反应,生成二氧化硫气体的体积为3.36L(标准状况下).已知:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.试计算:(1)反应后生成硫酸铜的物质的量;
(2)将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?
分析 (1)Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,利用等量代换列式计算出生成硫酸铜的物质的量;
(2)根据c=$\frac{n}{V}$计算出所得硫酸铜溶液的物质的量浓度.
解答 解:(1)Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4 +SO2↑+2H2O
1mol 22.4L
n(CuSO4) 3.36L
则:n(CuSO4)=$\frac{1mol×3.36L}{22.4L}$=0.15mol,
答:反应生成硫酸铜的物质的量为0.15mol;
(2)将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度为:c(CuSO4)=$\frac{0.15mol}{0.5L}$=0.3mol•L-1,
答:该溶液中溶质的物质的量浓度是0.3mol•L-1.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握等量代换法在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
16.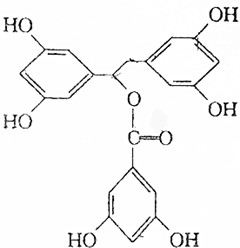 某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )
某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )
 某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )
某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )| A. | 7:9:9 | B. | 8:9:9 | C. | 7:10:9 | D. | 7:9:6 |
14.下列叙述正确的是( )
| A. | 0.1 mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| B. | 常温下,pH=2的CH3COOH溶液和H2SO4溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离出的c(H+)不相等 | |
| C. | 常温下将浓度为0.1 mol•L-1的HF溶液加水不断稀释,溶液中$\frac{c({H}^{+})}{c(HF)}$的值始终保持增大 | |
| D. | 常温下0.1 mol•L-1的下列溶液①NH4Fe(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ |
1.下列既能和酸性氧化物反应又能跟碱性氧化物反应,它本身也属于氧化物的是( )
| A. | CO2 | B. | Ca(OH)2 | C. | H2O | D. | CaO |
11.X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如表:
(1)X的电负性比Y的小(填“大”或“小”).
(2)写出W的价电子排布式3d64s2,写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2,当1摩尔Z2Y2参加反应时,转移电子的数目:NA(或6.02×1023).
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:CO2+CO32-+H2O═2HCO3-.
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是SiH4(写化学式).
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)写出W的价电子排布式3d64s2,写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2,当1摩尔Z2Y2参加反应时,转移电子的数目:NA(或6.02×1023).
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:CO2+CO32-+H2O═2HCO3-.
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是SiH4(写化学式).
18.下列物质属纯净物的是( )
| A. | 氨水 | B. | 王水 | C. | 含有白磷的红磷 | D. | 液氨 |
16.氮元素是植物生长所需的重要元素.将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如下表:
现有常温下0.1mol•L-1的(NH4)2CO3溶液,
(1)你认为该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
(2)就该溶液中粒子之间有下列关系式,你认为其中正确的是CD.
A.c (NH3•H2O)>c (NH4+)>c (CO32-)>c (HCO3-)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-)+c (HCO3-)+c (H2CO3)=0.1mol•L-1
D.c (NH4+)+c (NH3•H2O)=2c (CO32-)+2c (HCO3-)+2c (H2CO3)
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
(1)你认为该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
(2)就该溶液中粒子之间有下列关系式,你认为其中正确的是CD.
A.c (NH3•H2O)>c (NH4+)>c (CO32-)>c (HCO3-)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-)+c (HCO3-)+c (H2CO3)=0.1mol•L-1
D.c (NH4+)+c (NH3•H2O)=2c (CO32-)+2c (HCO3-)+2c (H2CO3)
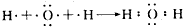 .
.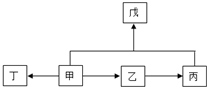 (3)A、B、C三种元素能形成多种化合物.某化合物甲一分子中含有一个氧原子,相对分子质量为46,其存在如图转化关系:
(3)A、B、C三种元素能形成多种化合物.某化合物甲一分子中含有一个氧原子,相对分子质量为46,其存在如图转化关系: ;
; .
.