题目内容
16.氮元素是植物生长所需的重要元素.将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如下表:| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
(1)你认为该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
(2)就该溶液中粒子之间有下列关系式,你认为其中正确的是CD.
A.c (NH3•H2O)>c (NH4+)>c (CO32-)>c (HCO3-)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-)+c (HCO3-)+c (H2CO3)=0.1mol•L-1
D.c (NH4+)+c (NH3•H2O)=2c (CO32-)+2c (HCO3-)+2c (H2CO3)
分析 (1)依据弱电解质电离平衡常数比较弱电解质强弱,盐类水解原理分析判断溶液酸碱性;
(2)依据溶液中离子性质,电荷守恒、物料守恒、离子浓度大小比较的方法分析选择.
解答 解:(1)分析电离平衡常数可知电离程度,NH3•H2O>H2CO3>HCO3-,对应盐水解程度NH4+<HCO3-<CO32-,常温下0.1mol•L-1的(NH4)2CO3溶液呈碱性,由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性;
故答案为:碱;由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性;
(2)A.溶液中铵根离子浓度大于碳酸根离子浓度,碳酸根离子水解程度大于铵根离子水解程度,所以溶液中离子浓度大小为:c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O),故A错误;
B.溶液中存在电荷守恒为:c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故B错误;
C.依据溶液中物料守恒得到:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1 ,故C正确;
D.依据溶液中物料守恒,n(N):n(C)=2:1,结合溶液中离子种类和守恒关系得到:c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D正确;
故答案为:CD.
点评 本题考查了热化学方程式书写方法,化学平衡影响因素分析,电解质溶液中离子浓度关系的应用判断,掌握基础是关键,题目难度中等.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
7.碳酸二甲酯(简称DMC)是一种新化工原料,2008年在欧洲被誉为“非毒性化学品”.下列关于DMC的说法中正确的是( )
| A. | DMC的结构简式为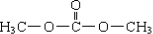 | |
| B. | DMC在空气不能燃烧 | |
| C. | DMC易溶于水,不溶于乙醇和丙酮 | |
| D. | DMC用于生产非毒性化工产品,故被誉为有机合成的“绿色化工原料” |
11.如果将氧化还原反应:4NH3+3O2═2N2+6H2O设计成原电池,则其正极或负极的电极反应式不可能是( )
| A. | O2+4H++4e-=2H2O | B. | O2+2H2O+4e-=4OH- | ||
| C. | N2H4+4OH--4e-=N2+4H2O | D. | N2H4+4H++2e-=2NH4+ |
1.同周期的X、Y、Z三种元素,已知其最高价氧化物相应水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中,正确的是( )
| A. | 阴离子的还原性:Z>Y>X | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:X<Y<Z | D. | 原子原子半径:X>Y>Z |
8.下列叙述正确的是( )
| A. | 25℃时向水中加入少量固体CH3COONa,平衡逆向移动,c (H+)降低,Kw不变 | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 向Na2CO3溶液中加入NaOH溶液后,c(CO32- )减少 | |
| D. | 某温度时的混合溶液中c(H+)=$\sqrt{{K}_{W}}$mol•L-1,说明该溶液呈中性(KW为该温度时水的离子积常数) |
4.下列图示关系不正确的是( )
| A. | 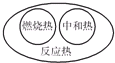 | B. | 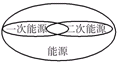 | C. |  | D. | 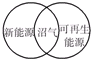 |
5.下列指定微粒的数目相等的是( )
| A. | 等物质的量的水与重水含有的中子数 | |
| B. | 等质量的O2和O3含有的原子数 | |
| C. | 同温、同压同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁分别与足量氯气和硫完全反应时转移的电子数 |