题目内容
19.高锰酸钾不能用盐酸来酸化,原因是酸性高锰酸钾氧化性极强.比如高锰酸钾很容易与热的浓盐酸发生如下反应:KMnO4+HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+MnCl2+Cl2↑+H2O(1)配平上述化学方程式2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
(2)参加氧化还原反应的HCl占参与反应的HCl总量的62.5%;
(3)此反应的离子方程式是:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
分析 (1)反应中高锰酸钾中的锰元素化合价从+7价降为氯化锰中+2价,氯化氢中-1价的氯,部分升高到氯气中0价,依据氧化还原反应中得失电子守恒规律结合原子个数守恒规律书写化学方程式;
(2)由反应方程式可知:参加氧化还原反应的HCl是10mol,参与反应的HCl总量的16mol,由此分析解答;
(3)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,中钾离子未参加离子反应,而氯离子部分参加离子反应,所以反应的离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
解答 解:(1)反应中高锰酸钾中的锰元素化合价从+7价降为氯化锰中+2价,氯化氢中-1价的氯,部分升高到氯气中0价,1mol高锰酸钾参加反应得到5mol电子,生成1mol氯气,有2mol氯离子失去2mol电子,要使氧化还原中得失电子守恒,则最小公倍数为10,高锰酸钾系数为2,氯气系数为5,依据锰、钾原子个数守恒,氯化钾系数为2,氯化锰系数为2,依据氯原子个数守恒,氯化氢系数为16,依据氢原子个数守恒,水分子系数为8,化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
(2)由反应方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O可知:参加氧化还原反应的HCl是10mol,参与反应的HCl总量的16mol,所以参加氧化还原反应的HCl占参与反应的HCl总量的$\frac{10}{16}$×100%=62.5%,故答案为:62.5;
(3)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,中钾离子未参加离子反应,而氯离子部分参加离子反应,所以反应的离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
点评 本题考查了氧化还原反应方程式的书写,明确氧化还原反应方程式中氧化剂、还原剂得失电子守恒、原子个数守恒是解题关键,题目难度不大.

 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案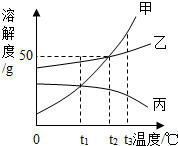
| A. | t1℃时,分别取出相同质量的甲、丙两种饱和溶液升温到t2℃时,甲和乙溶质的质量分数相等 | |
| B. | t2℃时,将甲、乙两种饱和溶液分别恒温蒸发等质量的水,析出晶体的质量可能不等 | |
| C. | 将三种饱和溶液分别从t3℃降低到t2℃时,甲和乙溶质的质量分数减小,丙的溶质的质量分数不变 | |
| D. | 当甲的饱和溶液中含有少量乙时,可以采取冷却热饱和溶液的办法提取乙 |
| A. | C+CO2 $\frac{\underline{\;加热\;}}{\;}$2CO | B. | 2H2+O2 $\frac{\underline{\;高温\;}}{\;}$2H2O | ||
| C. | CaCO3 $\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2 | D. | 水蒸汽凝结成水 |
| 化合物 | 燃烧热/kJ/mol | 化合物 | 燃烧热/kJ/mol |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2甲基丁烷 | 3 531.3 |
| A. | 正戊烷的燃烧热大于3 531.3 kJ•mol-1 | |
| B. | 稳定性:正丁烷>异丁烷 | |
| C. | 乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1 560.8 kJ•mol-1 | |
| D. | 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
| A. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 硫酸铝溶液中加入偏铝酸钠溶液:Al3++3AlO2-+6H2O=4Al(OH)3↓ | |
| C. | FeS固体放入稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ | |
| D. | 氯化铝溶液中加入过量氨水Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
| A. | 常温常压下,32 g 氧气所含的原子数为NA | |
| B. | 1.8 g NH4+中含有的质子数NA | |
| C. | 常温常压下,48 g O3含有的氧原子数为3NA | |
| D. | 2.4 g 金属镁变为镁离子时失去的电子数为0.1 NA |

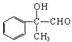
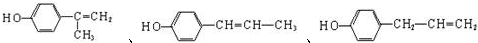 .
.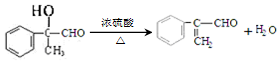 .
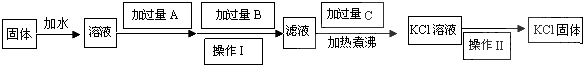
.
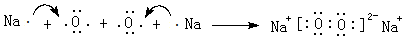 ,工业冶炼单质E的化学方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
,工业冶炼单质E的化学方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.