题目内容
16.下列物质的性质与实际应用对应关系错误的是( )| 选项 | 物质的性质 | 实际应用 |
| A | 二氧化锰具有强氧化性 | 用作H2O2分解的氧化剂 |
| B | 液氨汽化时要吸收大量的热 | 用作制冷剂 |
| C | Al2O3熔点高 | 用作耐高温材料 |
| D | 肥皂水显碱性 | 用作蚊虫叮咬处的清洗剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.过氧化氢分解中二氧化锰做催化剂;
B.氨气汽化吸收大量的热,具有制冷作用;
C.耐高温材料应具有较高的熔点;
D.蚊虫叮咬排放甲酸.
解答 解:A.过氧化氢分解中二氧化锰做催化剂,不表现氧化性,故A错误;
B.氨气汽化吸收大量的热,具有制冷作用,可以做制冷剂,故B正确;
C.氧化铝熔点高,可用作耐高温材料,故C正确;
D.蚊虫叮咬排放甲酸,肥皂水显碱性,酸碱中和可以减少痛疼,故D正确;
故选:A.
点评 本题考查了元素化合物知识,侧重考查元素化合物的性质,熟悉相关物质的性质是解题关键,题目难度不大.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
11.生产中常要控制化学反应条件增大反应速率.下列措施中不能加快化学反应速率的是( )
| A. | 尽可能使用稀溶液 | B. | 选择合适的催化剂 | ||
| C. | 碾细固体反应物 | D. | 提高反应体系的温度 |
1.下列反应的离子方程式书写正确的是( )
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
8.(1)与标准状况下4.48L CO2中所含氧原子数目相同的水的质量是7.2g;
(2)V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42-的物质的量浓度为$\frac{3m}{112V}$mol/L;
(3)9.2g氮的氧化物(NOx)中含氮原子0.2mol,则x的数值为2;
(4)0.4mol某气体的体积为9.8L,则该气体的摩尔体积为24.5L/mol,气体所处的条件不是(填“是”或“不是”)标准状况.
(5)下列是常用的中和胃酸的药物:
估算10片胃舒平和5片达喜,含铝的物质的量较多的是10片胃舒平.
(2)V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42-的物质的量浓度为$\frac{3m}{112V}$mol/L;
(3)9.2g氮的氧化物(NOx)中含氮原子0.2mol,则x的数值为2;
(4)0.4mol某气体的体积为9.8L,则该气体的摩尔体积为24.5L/mol,气体所处的条件不是(填“是”或“不是”)标准状况.
(5)下列是常用的中和胃酸的药物:
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成份的药量 | 0.245g | 0.5g |
5.(1)写出H2C2O4与KMnO4酸性溶液反应的化学方程式.5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O
(2)若要测定此反应的化学反应速率,最方便的测定方法是测定溶液紫红色褪色时间;
基于此,在实验时H2C2O4与KMnO4初始物质的量需要满足的关系为n(H2C2O4):n (KMnO4)≥$\frac{5}{2}$.
(3)为研究温度、浓度对此反应速率的影响,请完成以下表格
(2)若要测定此反应的化学反应速率,最方便的测定方法是测定溶液紫红色褪色时间;
基于此,在实验时H2C2O4与KMnO4初始物质的量需要满足的关系为n(H2C2O4):n (KMnO4)≥$\frac{5}{2}$.
(3)为研究温度、浓度对此反应速率的影响,请完成以下表格
| 编号 | 0.1mol/L H2C2O4 溶液的体积/mL | 0.01mol/L 酸性 KMnO4 的体积/mL | 蒸馏水的体积/mL | 温度/℃ |
| ① | 2 | 4 | 2 | 25 |
| ② | 3 | |||
| ③ | 50 |
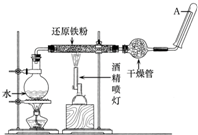 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.