题目内容
8.以下有关元素性质的说法不正确的是( )| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是① | |
| B. | 下列原子的价电子排布中,①3s23p1 ②3s23p2 ③3s23p3④3s23p4,对应的第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④ | |
| D. | 某元素的逐级电离能(kJ•mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是X3+ |
分析 A、①1s22s22p63s23p2 是硅,②1s22s22p3 是氮,③1s22s22p2 是碳,④1s22s22p63s23p4是硫;
B、当最外层处于半充满或全充满时,难以失去电子,则第一电离能最大;
C、同周期自左而右电负性增大,同主族自上而下电负性减小;
D、该元素第三电离能剧增,最外层应有2个电子,表现+2价.
解答 解:A、①1s22s22p63s23p2 是硅,②1s22s22p3 是氮,③1s22s22p2 是碳,④1s22s22p63s23p4是硫,电子层数越多半径越大,电子层数相同时,核电荷数越鑫半径越小,所以原子半径最大的是硅,故A正确;
B、①3s23p1 ②3s23p2 ③3s23p3④3s23p4,依次是Al、Si、P、S,同周期第二和第五主族元素的电离能大于相邻有其它元素,所以P的第一电离能最大,故B正确;
C、同周期自左而右电负性增大,同主族自上而下电负性减小,故①Na、K、Rb电负性依次减小,②N、P、As的电负性依次减小,③O、S、Se的电负性依次减小 ④Na、P、Cl的电负性依次增大,故C正确;
D、该元素第三电离能剧增,最外层应有2个电子,表现+2价,当它与氯气反应时最可能生成的阳离子是X2+,故D错误;
故选:D.
点评 本题考查核外电子排布、微粒半径比较、电离能与电负性等,难度中等,注意理解电离能与元素化合价关系、同周期第一电离能发生突跃原理.

练习册系列答案
相关题目
18.将0.05molSO2(g)和0.03molO2(g)放入容积为2L的密闭容器中,反应2SO2(g)+O2(g)?2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.02mol•L-1.以下表述正确的是( )
| A. | 该条件下反应的平衡常数为1.6×103 | |
| B. | 通常情况下,该反应一定能自发进行 | |
| C. | 题给条件下,SO2的转化率是80% | |
| D. | 当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态 |
16. 氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是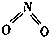 和
和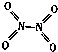 .实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
.实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
(1)写出N2O4转化NO2为的热化学方程式N2O4(g)?2NO2(g)△H=+57 kJ•mol-1.
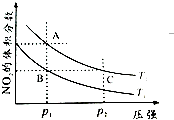
(2)对反应N2O4(g)?2NO2(g),在温度T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.
①A、C两点的反应速率v(A)<v(C)(填“>”“=”或“<”).
②B、C两点的气体平均相对分子质量M(B)=M(C)(填“>”、“=”或“<”).
③由状态B到达状态A可用的方法是加热.
④A点气体的颜色比C点浅(填“深”、“浅”或“相同”),原因是A点到C点时压强增大,即体积减小,平衡逆移,NO2的体积分数减小,但平衡时C点c(NO2)比A点大.
(3)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表所示数据.
①在上述条件下,从反应开始直至20s时,v(NO2)=0.0025mol•L-1•s-1.
②若在相同的情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度应是0.10 mol•L-1.
 氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是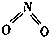 和
和 .实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
.实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.(1)写出N2O4转化NO2为的热化学方程式N2O4(g)?2NO2(g)△H=+57 kJ•mol-1.
(2)对反应N2O4(g)?2NO2(g),在温度T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.
①A、C两点的反应速率v(A)<v(C)(填“>”“=”或“<”).
②B、C两点的气体平均相对分子质量M(B)=M(C)(填“>”、“=”或“<”).
③由状态B到达状态A可用的方法是加热.
④A点气体的颜色比C点浅(填“深”、“浅”或“相同”),原因是A点到C点时压强增大,即体积减小,平衡逆移,NO2的体积分数减小,但平衡时C点c(NO2)比A点大.
(3)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表所示数据.
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②若在相同的情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度应是0.10 mol•L-1.
13.下列性质的比较正确的是( )
| A. | 酸性:H2SiO3<H2CO3 | B. | 碱性:Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:SiH4>PH3 | D. | 原子半径:N<C |
20.下列物质中,常温下既能跟盐酸反应,又能跟NaOH溶液反应的是( )
| A. | MgO | B. | Al2O3 | C. | SiO2 | D. | Cl2 |