题目内容
18.加热H2C2O4•2H2O,释放出气体通入澄清石灰水,出现浑浊.(1)H2C2O4•2H2O热分解反应方程式为H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+3H2O.
(2)由上可知,Na2C2O4热分解反应方程式为Na2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO↑.
分析 (1)加热H2C2O4•2H2O,释放出气体通入澄清石灰水,结合原子个数守恒书写方程式;
(2)Na2C2O4热分解生成碳酸钠和一氧化碳.
解答 解:(1)加热H2C2O4•2H2O,释放出气体通入澄清石灰水,结合原子个数守恒,可知反应生成二氧化碳、一氧化碳和水,化学方程式:H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+3H2O;
故答案为:H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+3H2O;
(2)Na2C2O4热分解生成碳酸钠和一氧化碳,化学方程式:Na2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO↑,故答案为:Na2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO↑.
点评 本题考查了化学方程式的书写,明确有机物结构是解题关键,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
8.以下有关元素性质的说法不正确的是( )
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是① | |
| B. | 下列原子的价电子排布中,①3s23p1 ②3s23p2 ③3s23p3④3s23p4,对应的第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④ | |
| D. | 某元素的逐级电离能(kJ•mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是X3+ |
6.下列离子在给定条件下,可能大量共存的是( )
| A. | 某无色透明的溶液中:Ca2+、NH4+、CO32-、HCOO- | |
| B. | 溶解有AlCl3的溶液中:Na+、K+、SO42-、S2- | |
| C. | 25℃时,水电离出的c(H+)=1×l0-l3mol/L的溶液中:K+、Ba2+、NO3-、I- | |
| D. | 离子浓度均为0.1mol/L的溶液中:Na+、Fe3+、CH3COO-、NO3- |
10.(1)电渗析法淡化海水时,其原理如图所示,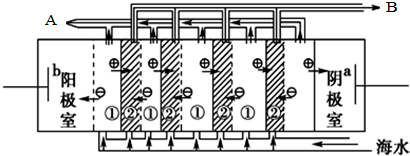 ,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.
,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.
(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发 池和结晶池,建盐田必须在BC处建立(填序号).
A.选在离江河入海口比较近的地方
B.多风少雨
C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe2+、SO42-等离子,流程如下:
粗盐水$→_{过程Ⅰ}^{过量BaCl_{2}溶液}$$→_{过程Ⅱ}^{过量Na_{2}CO_{3}溶液}$$→_{过程Ⅲ}^{过量NaOH溶液}$$→_{过程Ⅳ}^{过滤}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20℃部分沉淀的溶解度(g)如表
①检测Fe3+是否除尽的方法是取过程Ⅳ的滤液于试管中,向其中滴加KSCN溶液,若溶液不变色证明Fe3+已经沉淀干净,反之没除净;
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
 ,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.
,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发 池和结晶池,建盐田必须在BC处建立(填序号).
A.选在离江河入海口比较近的地方
B.多风少雨
C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe2+、SO42-等离子,流程如下:
粗盐水$→_{过程Ⅰ}^{过量BaCl_{2}溶液}$$→_{过程Ⅱ}^{过量Na_{2}CO_{3}溶液}$$→_{过程Ⅲ}^{过量NaOH溶液}$$→_{过程Ⅳ}^{过滤}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20℃部分沉淀的溶解度(g)如表
| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
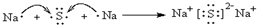 .
.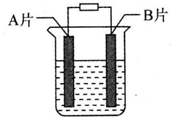 【实验目的】利用所学知识,设计原电池装置.
【实验目的】利用所学知识,设计原电池装置.