题目内容
15.W、X、Y、Z为原子序数依次增大的四种短周期主族元素,它们的最外层电子数之和为22,W与Y同主族,W2-具有与氖原子相同的电子层结构.下列说法正确的是( )| A. | 简单离子半径:Y>X>W | B. | 单质的氧化性:W>Y>Z | ||
| C. | 化合物ZW2具有强还原性 | D. | 化合物Y2Z2中只含共价键 |
分析 W、X、Y、Z为原子序数依次增大的四种短周期主族元素,W2-具有与氖原子相同的电子层结构,则W为O元素;W与Y同主族,则Y为S元素,可知Z为短周期原子序数最大的主族元素Cl;它们的最外层电子数之和为22,可知X的最外层电子数为22-6-6-7=3,X为Al元素,结合元素周期律来解答.
解答 解:W、X、Y、Z为原子序数依次增大的四种短周期主族元素,W2-具有与氖原子相同的电子层结构,则W为O元素;W与Y同主族,则Y为S元素,可知Z为短周期原子序数最大的主族元素Cl;它们的最外层电子数之和为22,可知X的最外层电子数为22-6-6-7=3,X为Al元素,
A.电子层越多,离子半径越大,具有相同电子排布的离子原子序数大的离子半径小,则简单离子半径:Y>W>X,故A错误;
B.非金属性越强,单质的氧化性越强,则氧化性为W>Z>Y,故B错误;
C.化合物ZW2具有强氧化性,一般用作自来水消毒剂,故C错误;
D.化合物Y2Z2中,只含S-Cl、S-S共价键,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的推断为解答的关键,侧重分析与推断、应用能力的考查,题目难度不大.

练习册系列答案
相关题目
8.短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素.其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外),W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21,下列说法正确的是( )
| A. | 气态氢化物的稳定性:X>Y | |
| B. | 最高价氧化物对应的水化物的酸性:Y>X>W | |
| C. | Q可分别与X、Y、Z、W形成化学键类型相同的化合物 | |
| D. | Y的简单离子半径小于Z的简单离子半径 |
10.在一个可逆反应中:2SO2+O2$?_{加热}^{催化剂}$2SO3,向容器中加入18O2,达到平衡后,存在18O物质的说法正确的是( )
| A. | 只有O2 | B. | 只有O2、SO3 | ||
| C. | 只有O2、SO2 | D. | SO2、O2、SO3中都有 |
 2NH3(g) ΔH = -38.6 kJ/mol
2NH3(g) ΔH = -38.6 kJ/mol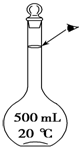 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤: