题目内容
19.X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料.用化学用语回答下列问题:(1)X的元素符号为H;L在元素周期表中的位置为第3周期第ⅣA族.
(2)Y、M的氢化物的稳定性由小到大的顺序是CH4<HCl(用化学式表示)
(3)Y的最高价氧化物的化学式为CO2.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
分析 W是地壳中含量最多的金属元素,则W是Al.L的单质晶体熔点高、硬度大,是一种重要的半导体材料,且原子序数大于铝的,所以L是Si.X、M的单质是气体,原子序数大于Si的,所以M是Cl.Y的原子最外层电子数是其电子层数的2倍,原子序数小于铝的,所以Y是C.X的原子序数小于C的,所以X是氢.Z在同周期的主族元素中原子半径最大,则Z是Na,由此分析解答.
解答 解:W是地壳中含量最多的金属元素,则W是Al.L的单质晶体熔点高、硬度大,是一种重要的半导体材料,且原子序数大于铝的,所以L是Si.X、M的单质是气体,原子序数大于Si的,所以M是Cl.Y的原子最外层电子数是其电子层数的2倍,原子序数小于铝的,所以Y是C.X的原子序数小于C的,所以X是氢.Z在同周期的主族元素中原子半径最大,则Z是Na,
(1)X的元素是氢元素,元素符号为:H,L是硅元素周期表中的位置为第3周期第ⅣA族,故答案为:H;第3周期第ⅣA族;
(2)碳的非金属性弱于氯的非金属性,所以氢化物的稳定性由小到大的顺序是CH4<HCl,故答案为:CH4<HCl;
(3)Y的最高价氧化物为CO2,原子序数比C多2的是氧,和氢形成的化合物双氧水分解生成氧气和水,反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:CO2;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(4)钠、铝各自的最高价氧化物对应的水化物分别是氢氧化钠和氢氧化铝,可以反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查结构性质位置关系、常用化学用语、元素化合物性质等,题目难度中等,推断元素是解题的关键,注意基础知识的理解掌握.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案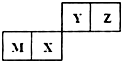
| A. | M与Z形成的化合物中只存在离子键 | |
| B. | X的最简单气态氢化物的热稳定性比Z的强 | |
| C. | 原子半径Z>Y | |
| D. | M的最高价氧化物对应水化物能与NaOH溶液反应 |
| A. | 标况下,22.4 L SO3中含有NA个SO3分子 | |
| B. | 1 mol/L NaCl溶液含有NA个Na+ | |
| C. | 1 mol Fe和足量稀硝酸反应产生22.4LNO | |
| D. | 16 g CH4中含有4 NA个C-H键 |
①原子间的相互吸引力叫做化学键 ②两个非金属原子间不可能形成离子键 ③强电解质的分子中一定存在离子键 ④原子之间形成化学键的过程是能量降低的过程 ⑤所有的单质分子中都存在非极性共价键 ⑥全部由非金属元素组成的化合物不一定是共价化合物.
| A. | ①③⑤ | B. | ②④⑥ | C. | ①④⑥ | D. | ③⑤⑥ |
| A. | SiO2不与任何酸反应 | |
| B. | Cl2是一种有强烈刺激性气味的有毒气体 | |
| C. | NO2易溶于水,且能与水反应 | |
| D. | SO2是酸性氧化物,是形成酸雨的主要气体 |
| A. | 气态氢化物的稳定性:X>Y | |
| B. | 最高价氧化物对应的水化物的酸性:Y>X>W | |
| C. | Q可分别与X、Y、Z、W形成化学键类型相同的化合物 | |
| D. | Y的简单离子半径小于Z的简单离子半径 |
 .
.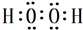 ,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式Cu+2H++H2O2=Cu2++2H2O.
,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式Cu+2H++H2O2=Cu2++2H2O. A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构. ,CB2的电子式为
,CB2的电子式为 .
.