题目内容
16.通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是( )| A. | NCl3分子是非极性分子 | |
| B. | 分子中的所有原于均达到8电子稳定结构 | |
| C. | NBr3的熔点比NCl3的熔点低 | |
| D. | 分子中N-C1键键长比CCl4分子中C-C1键键长长 |
分析 A.因为NC13是一种油状液体,其分子空间构型与氨分子相似,依据氨气分子结构判断其极性;
B.如果元素的最外层电子数+元素的化合价的绝对值=8,该元素就达到8电子稳定结构,否则没有达到8电子稳定结构;
C.分子晶体熔沸点高低与相对分子质量成正比;
D.原子半径越小,原子间形成的键长越短.
解答 解:A.NC13的分子空间构型与氨分子相似,都是三角锥型结构,氨分子是极性分子,所以NCl3分子也是极性分子,故A错误;
B.NC13中N原子最外层电子数5+化合价的绝对值3=8,所以N原子达到8电子稳定结构;NC13中C1原子最外层电子数7+化合价的绝对值1=8,所以C1原子达到8电子稳定结构,故B正确;
C.NBr3和NCl3都是分子晶体,前者相对分子质量大于后者,所以前者熔点高,故C错误;
D.C原子的原子半径大于N原子的原子半径,所以CCl4中C-C1键键长比NC13中N-C1键键长,故D错误;
故选:B.
点评 本题考查了物质的结构与性质,明确熔沸点大小的判断方法、化合物中原子最外层电子数是否为8的判断方法、原子半径与键长的关系即可解答本题,注意对知识的迁移应用.

练习册系列答案
相关题目
6.对烷烃CH3CH(C2H5)CH(C2H5)CH(CH3)2的命名,正确的是( )
| A. | 2,3-二甲基-4-乙基戊烷 | B. | 2-甲基3,4-二乙基戊烷 | ||
| C. | 2,4-二甲基-3-乙基己烷 | D. | 2,5-二甲基-3-乙基己烷 |
7.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标况下,22.4 L SO3中含有NA个SO3分子 | |
| B. | 1 mol/L NaCl溶液含有NA个Na+ | |
| C. | 1 mol Fe和足量稀硝酸反应产生22.4LNO | |
| D. | 16 g CH4中含有4 NA个C-H键 |
4.下列说法不正确的是( )
| A. | SiO2不与任何酸反应 | |
| B. | Cl2是一种有强烈刺激性气味的有毒气体 | |
| C. | NO2易溶于水,且能与水反应 | |
| D. | SO2是酸性氧化物,是形成酸雨的主要气体 |
1.草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4•2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3的目的是还原Fe3+、Co3+为Fe2+、Co2+.
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O?R(OH)3+3H+,向右移动,而产生氢氧化物沉淀
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液$\frac{{c({M{g^{2+}}})}}{{c({C{a^{2+}}})}}$=0.7.
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,在滤液II中适宜萃取的pH为3.0~3.5左右.
(6)已知:NH3•H2O?NH4++OH- Kb=1.8×10-5;
H2C2O4?H++HC2O4- Ka1=5.4×10-2;HC2O4-?H+C2O42- Ka2=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是Co3O4(或CoO•Co2O3)


已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O?R(OH)3+3H+,向右移动,而产生氢氧化物沉淀
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液$\frac{{c({M{g^{2+}}})}}{{c({C{a^{2+}}})}}$=0.7.
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,在滤液II中适宜萃取的pH为3.0~3.5左右.
(6)已知:NH3•H2O?NH4++OH- Kb=1.8×10-5;
H2C2O4?H++HC2O4- Ka1=5.4×10-2;HC2O4-?H+C2O42- Ka2=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是Co3O4(或CoO•Co2O3)

8.短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素.其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外),W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21,下列说法正确的是( )
| A. | 气态氢化物的稳定性:X>Y | |
| B. | 最高价氧化物对应的水化物的酸性:Y>X>W | |
| C. | Q可分别与X、Y、Z、W形成化学键类型相同的化合物 | |
| D. | Y的简单离子半径小于Z的简单离子半径 |
 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构. ,CB2的电子式为
,CB2的电子式为 .
.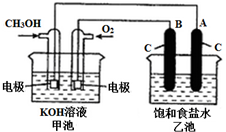 甲醇是一种可再生能源,具有广泛的开发和应用前景.图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
甲醇是一种可再生能源,具有广泛的开发和应用前景.图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O