题目内容
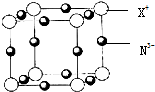
 如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡.试回答:
如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡.试回答:(1)p为
(2)C为
(3)C极的电极反应式是
(4)在电解过程中,测得的C、D两极上产生的气体的实验数据如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体体积 (cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成气体体积 (cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
(5)当反应进行一段时间后,A、B电极所在的电解池中溶液的pH
(6)当电路中通过0.004mol电子时,B电极上沉积金属X为0.128g,则此金属的摩尔质量为
考点:电解原理
专题:电化学专题
分析:(1)接通电源,金属M沉积于B极,同时C、D产生气泡,则B为阴极,M离子在阴极放电生成金属单质,则A、C是阳极,B、D是阴极,连接阳极的是电源正极;
(2)电解硫酸溶液时,阳极上氢氧根离子放电,阴极上氢离子放电;
(3)C电极是电解池阳极,阳极上氢氧根离子放电;
(4)根据氢气和氧气的溶解性和溶解度等方面进行分析;
(5)根据溶液中的氢离子和氢氧根离子浓度是否变化确定;
(6)根据金属和转移电子之间的关系式计算.
(2)电解硫酸溶液时,阳极上氢氧根离子放电,阴极上氢离子放电;
(3)C电极是电解池阳极,阳极上氢氧根离子放电;
(4)根据氢气和氧气的溶解性和溶解度等方面进行分析;
(5)根据溶液中的氢离子和氢氧根离子浓度是否变化确定;
(6)根据金属和转移电子之间的关系式计算.
解答:
解:(1)接通电源,金属M沉积于B极,同时C、D产生气泡,则B为阴极,M离子在阴极放电生成金属单质,则A、C是阳极,B、D是阴极,所以p是正极,A电极上失电子发生氧化反应,故答案为:正;氧化;
(2)由(1)知,C是阳极,D是阴极,阳极上氢氧根离子放电生成氧气,故答案为:阳;氧气;
(3)C是阳极,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(4)氢气和氧气都难溶于水,但是氧气更易溶于水;所以1~6分钟内氧气比氢气溶解的快而多,从而导致阴、阳两极生成的气体体积之比大于2:1;
故答案为:开始时阴、阳两极气体体积比为3:1,10分钟时约为2:1,说明开始时氧气溶解于溶液中;
(5)该电解池中,阳极上电极材料放电生成金属阳离子进入溶液,阴极上金属阳离子放电生成金属析出,进入的金属阳离子和析出的金属阳离子相等,所以溶液中的氢离子和氢氧根离子浓度都不变,则溶液的pH不变,故答案为:不变;
(6)设其摩尔质量为M,
电解时,B电极上的电极反应式为:X 2++2e-=X
2mol 1mol
0.004mol
M=
=64g/mol,
故答案为:64g/mol.
(2)由(1)知,C是阳极,D是阴极,阳极上氢氧根离子放电生成氧气,故答案为:阳;氧气;
(3)C是阳极,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(4)氢气和氧气都难溶于水,但是氧气更易溶于水;所以1~6分钟内氧气比氢气溶解的快而多,从而导致阴、阳两极生成的气体体积之比大于2:1;
故答案为:开始时阴、阳两极气体体积比为3:1,10分钟时约为2:1,说明开始时氧气溶解于溶液中;
(5)该电解池中,阳极上电极材料放电生成金属阳离子进入溶液,阴极上金属阳离子放电生成金属析出,进入的金属阳离子和析出的金属阳离子相等,所以溶液中的氢离子和氢氧根离子浓度都不变,则溶液的pH不变,故答案为:不变;
(6)设其摩尔质量为M,
电解时,B电极上的电极反应式为:X 2++2e-=X
2mol 1mol
0.004mol
| 0.128g |
| M |
M=
| 0.128g×2mol |
| 0.004mol×1mol |
故答案为:64g/mol.
点评:本题考查电解原理,明确惰性电极电解时离子的放电顺序及发生的电极反应是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
| A、镁的原子失电子能力比钠弱 |
| B、氟的氢化物很稳定 |
| C、硫的氢化物比氧的氢化物更不稳定 |
| D、氢氧化钠是弱碱 |
下列解释事实的化学方程式或离子方程式,不正确的是( )
A、工业上可用电解法制备Mg:MgCl2
| ||||
| B、自然界中正常的雨水呈酸性:H2O+CO2?H2CO3?H++HCO3- | ||||
| C、用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) | ||||
| D、用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O |
下列鉴别方法可行的是( )
| A、用氨水鉴别Al3+、Mg2+和Ag+ |
| B、用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- |
| C、用水鉴别乙醇、甲苯、硝基苯 |
| D、用KMnO4酸性溶液鉴别苯、甲苯、环己烷 |
50g镁、锌、铁的混合物与足量的稀硫酸反应得到混合溶液,蒸发得到218g固体(换算为无水硫酸盐).则反应产生氢气的质量是( )
| A、3.5g | B、3g |
| C、2g | D、4.5g |
由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同.则该混合气体中CO2、H2和CO的体积比不可能为( )
| A、39:24:13 |
| B、22:7:14 |
| C、13:8:29 |
| D、26:16:57 |
 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.