题目内容
下列关于浓硫酸的叙述中,正确的是( )
| A、常温时,可与Al反应生成大量H2 |
| B、将浓硫酸置于敞口容器中,经过一段时间质量将减少 |
| C、稀释浓硫酸时,应将其沿着器壁慢慢加入到水中,并用玻璃棒不断搅拌 |
| D、硫酸是强酸,所以通常用浓硫酸与大理石反应制取二氧化碳 |
考点:浓硫酸的性质
专题:氧族元素
分析:A.常温下,浓硫酸和Al发生钝化现象;
B.浓硫酸具有吸水性;
C.浓硫酸稀释时,将浓硫酸倒入水中并不断搅拌;
D.实验室用稀盐酸和大理石制取二氧化碳.
B.浓硫酸具有吸水性;
C.浓硫酸稀释时,将浓硫酸倒入水中并不断搅拌;
D.实验室用稀盐酸和大理石制取二氧化碳.
解答:
解:A.常温下,浓硫酸和Al发生钝化现象而阻止铝进一步被氧化,且二者反应生成二氧化硫,故A错误;
B.浓硫酸具有吸水性,将浓硫酸置于敞口容器中,浓硫酸吸收空气中的水蒸气,所以经过一段时间质量将增加,故B错误;
C.浓硫酸稀释时,将浓硫酸倒入水中并不断搅拌,防止浓硫酸稀释过程中放出的热量使局部受热而溅出液体,产生安全事故,故C正确;
D.浓硫酸和大理石生成微溶物硫酸钙而阻止进一步反应,所以实验室用稀盐酸和大理石制取二氧化碳,故D错误;
故选C.
B.浓硫酸具有吸水性,将浓硫酸置于敞口容器中,浓硫酸吸收空气中的水蒸气,所以经过一段时间质量将增加,故B错误;
C.浓硫酸稀释时,将浓硫酸倒入水中并不断搅拌,防止浓硫酸稀释过程中放出的热量使局部受热而溅出液体,产生安全事故,故C正确;
D.浓硫酸和大理石生成微溶物硫酸钙而阻止进一步反应,所以实验室用稀盐酸和大理石制取二氧化碳,故D错误;
故选C.
点评:本题考查了浓硫酸的性质,涉及物质间的反应、基本操作等知识点,知道浓硫酸具有吸水性、脱水性、强氧化性和酸性,会解释钝化现象,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
下列化学用语使用不正确的是( )
A、Na+的结构示意图 |
| B、纯碱的化学式为Na2CO3 |
C、溴化铵的电子式: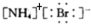 |
| D、高氯酸(HClO4)中氯元素的化合价为+7 |
下列有机物命名正确的是( )
A、 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 |
B、 1,3,4-三甲苯 1,3,4-三甲苯 |
C、 2-甲基-3-丁炔 2-甲基-3-丁炔 |
D、 2-甲基-1-丙醇 2-甲基-1-丙醇 |
不同温度下水的电离平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14,则下列正确的是( )
| A、c(H+)随温度的升高而增大 |
| B、水的电离过程是放热的 |
| C、水的电离平衡常数与浓度、温度有关 |
| D、在35℃时,c(H+)>c(OH─) |
分子式为C6H14O的醇,能氧化成醛的同分异构体共有(不考虑立体异构)( )
| A、6种 | B、7种 | C、8种 | D、9种 |
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、1L0.1mol?L-1 Na2CO3溶液中有NA个CO32- |
| B、常温常压下,22gCO2中共有2NA个共用电子对 |
| C、0.1mol Na2O2与水完全反应,转移的电子数为0.2NA |
| D、2.8gN2、CO和C2H4组成的混合气体所占有的体积约为2.24L |
下列实验中试剂选用正确的是( )
| A、用稀硝酸与铁反应制取氢气 |
| B、用酒精萃取碘水中的碘 |
| C、用盐酸鉴别苏打和食盐 |
| D、用氢氧化钠溶液与可溶性铝盐制备氢氧化铝 |
