题目内容
8.将90g两种物质组成的混合物与足量的盐酸反应,所生成的气体通入足量的Na2O2,Na2O2增重28g,该混合物的成分可能是( )| A. | Na2CO3和NaHCO3 | B. | Na2CO3和K2CO3 | C. | Ca(HCO3)2和NaHCO3 | D. | CaCO3和Ca(OH)2 |
分析 将90g两种物质组成的混合物与足量的盐酸反应生成二氧化碳,二氧化碳与过氧化钠反应生成碳酸钠,Na2O2增重28g,结合方程式计算消耗的二氧化碳,然后利用极限法计算.
解答 解:将90g两种物质组成的混合物与足量的盐酸反应生成二氧化碳,二氧化碳与过氧化钠反应生成碳酸钠,Na2O2增重28g,
2Na2O2+2CO2=2Na2CO3+O2 固体质量变化
156g 88g 212g 56g
1molNa2CO3为106g,与足量盐酸反应生成1mol二氧化碳;
1molNaHCO3为84g,与足量盐酸反应生成1mol二氧化碳;
1molK2CO3为138g,与足量盐酸反应生成1mol二氧化碳;
1molCaCO3为100g,与足量盐酸反应生成1mol二氧化碳;
1molCa(HCO3)2为162g,与足量盐酸反应生成2mol二氧化碳;
90g两种物质组成的混合物与足量的盐酸反应生成1mol二氧化碳,所以是Na2CO3和NaHCO3,
故选A.
点评 本题考查化学反应方程式的计算,把握物质的性质、发生的反应为解答的关键,侧重分析与计算能力的考查,注意固体增重的判断,题目难度中等.

练习册系列答案
相关题目
11.水芹烯、罗勒烯、月桂烯均为中药当归的成分,它们的结构简式如图所示:
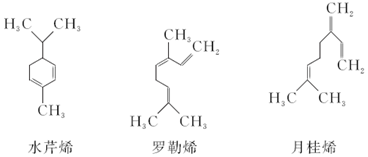
已知烯烃中不饱和碳原子与酸性KMnO4溶液反应的产物:
CH2=→HCOOH→CO2,RCH=→RCHO→RCOOH, →
→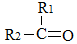
下列有关这三种有机物的判断正确的是( )

已知烯烃中不饱和碳原子与酸性KMnO4溶液反应的产物:
CH2=→HCOOH→CO2,RCH=→RCHO→RCOOH,
 →
→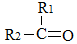
下列有关这三种有机物的判断正确的是( )
| A. | 三者互为同分异构体 | |
| B. | 三者与酸性KMnO4溶液反应的氧化产物中均有CO2 | |
| C. | 相同质量的三种物质与Br2发生加成反应消耗相同量的Br2 | |
| D. | 三者分子中所有碳原子均在同一个平面内 |
12.原子序数依次增大的五种短周期主族元素X、Y、Z、P、Q分别位于三个周期,X与Z、Y与P分别位于同主族,Z与Y可形成原子个数比分别为1:1和2:1的离子化合物.则下列说法正确的是( )
| A. | 单质的沸点:Q>P | |
| B. | 简单氢化物的热稳定性:Y>P | |
| C. | 简单离子的半径:Z>Y>X | |
| D. | X、Y、Z、P形成的化合物的水溶液显碱性 |
9.已知:RCH2OH$\stackrel{K_{2}Cr_{2}O_{7}/H+}{→}$RCHO$\stackrel{K_{2}Cr_{2}O_{7}/H+}{→}$RCOOH某有机物 X 的化学式为 C5H12O,能和钠反应放出氢气.X 经酸性重铬酸钾(K2Cr2O7)溶液氧化最终生成Y (C5H10O2),若不考虑立体结构.X和Y在一定条件下生成酯最多有( )
| A. | 32 种 | B. | 24 种 | C. | 16 种 | D. | 8 种 |
3.根据碘与氢气反应的热化学方程式
(ⅰ)I2(g)+H2(g)?2HI(g)△H=-9.48kJ•mol-1
(ⅱ)I2(s)+H2(g)?HI(g)△H=+26.48kJ•mol-1
下列判断正确的是( )
(ⅰ)I2(g)+H2(g)?2HI(g)△H=-9.48kJ•mol-1
(ⅱ)I2(s)+H2(g)?HI(g)△H=+26.48kJ•mol-1
下列判断正确的是( )
| A. | 1 mol I2(s)中通入2 g H2(g),反应吸热26.48 kJ | |
| B. | 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ | |
| C. | 反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低 | |
| D. | 反应(ⅰ)放出的热量多,所以产物的能量低,比反应(ⅱ)的产物更稳定 |
13.对于反应:M+N-→P,如果温度每升高10℃,化学反应速率提高到原来的3倍,在10℃时完成反应的10%需要81min,将温度提高到40℃时,完成反应的10%需要的时间为( )
| A. | 9 min | B. | 27 min | C. | 13.5 min | D. | 3 min |
20.向50mL14.0mol•L-1浓硝酸中加入足量的铜,充分反应后共收集到标准状况下2.24L NO和NO2混合气体(不考虑NO2与N2O4的相互转化),则参加反应的铜的质量为( )
| A. | 6.4g | B. | 12.8g | C. | 19.2g | D. | 38.4g |
17.一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是( )
| A. | 过量的NaOH溶液与AlCl3溶液 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18 mol/L硫酸 |
18.下列说法正确的是( )
| A. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ/mol | |
| B. | 在101 kPa时,1 mol H2完全燃烧生成水蒸气,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ/mol | |
| C. | 热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol表示1个固态碳原子和1分子水蒸气反应吸热131.1kJ | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,在相同条件下,将含0.5 mol H2SO4的稀硫酸与含1 mol Ba(OH)2的水溶液混合,放出的热量可能大于57.3 kJ |