题目内容
下列溶液显酸性的是( )
| A、NaCl溶液 |
| B、Na2CO3溶液 |
| C、AlCl3溶液 |
| D、KNO3溶液 |
考点:盐类水解的应用
专题:盐类的水解专题
分析:这几种物质都是盐,强酸弱碱酸式盐溶液呈强酸性,强酸弱碱盐溶液呈弱酸性,强酸强碱盐溶液呈中性,强碱弱酸盐溶液呈碱性,据此判断溶液pH大小.
解答:
解:A.氯化钠为强酸强碱盐,其溶液呈中性,故A错误;
B.碳酸钠为强碱弱酸盐,碳酸根离子水解而使其溶液呈弱碱性,故B错误;
C.氯化铝为强酸弱碱盐,铝离子水解而使其溶液呈弱酸性,故C正确;
D.KNO3为强酸强碱盐,其溶液呈中性,故D错误.
故选C.
B.碳酸钠为强碱弱酸盐,碳酸根离子水解而使其溶液呈弱碱性,故B错误;
C.氯化铝为强酸弱碱盐,铝离子水解而使其溶液呈弱酸性,故C正确;
D.KNO3为强酸强碱盐,其溶液呈中性,故D错误.
故选C.
点评:本题以溶液pH大小判断为载体考查了盐类水解,先根据盐的类型分类,再根据其电离或水解程度进行分类,难度不大.

练习册系列答案
相关题目
一个传热的固定容积的容器中发生反应:mA(g)+nB(g)?pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,一定 能说明达到平衡状态的标志是( )
| A、体系的压强不再改变 |
| B、各组分的浓度不再改变 |
| C、反应速率νA:νB:νC:νD=“m“:n:p:q |
| D、单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
下列电解质溶液的有关叙述正确的是( )
| A、在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
| B、pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后,溶液显碱性 |
| C、将足量CuSO4溶液在0.1mol?L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol?L-1(已知:Ksp(CuS)=1.3×10-36) |
| D、含1molKOH的溶液与1molCO2完全反应后,溶液中c(K+)=c(HCO3-) |
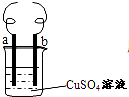 用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解液,如图所示,则下列说法正确的是( )
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解液,如图所示,则下列说法正确的是( )| A、构成原电池时b极反应式为:Cu2++2e-=Cu |
| B、构成电解池时a极质量一定减少 |
| C、构成电解池时b极质量可能减少也可能增加 |
| D、构成的原电池或电解池工作后,两电极均产生大量气体 |
下列关于油脂的叙述中正确的是( )
| A、油脂属于酯类 |
| B、天然油脂大多为单甘油酯 |
| C、油脂都不能使溴水或酸性高锰酸钾溶液褪色 |
| D、油脂在常温下的存在状态主要决定于分子中碳原子数的多少 |
某反应△H=+100kJ?mol-1,下列有关该反应的叙述正确的是( )
| A、正反应活化能小于100kJ?mol-1 |
| B、逆反应活化能一定小于100kJ?mol-1 |
| C、逆反应活化能大于正反应活化能 |
| D、正反应活化能不小于100kJ?mol-1 |
